向一密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。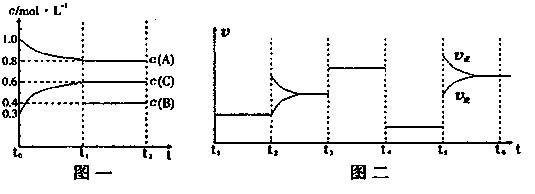
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。
该反应方程式可表示为
各阶段平衡时对应的平衡常数如下表所示:
| t1—t2 |
t2—t3 |
t3—t4 |
t4—t5 |
t5—t6 |
| K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为
K1 K2 K3 K4 K5 (用“>”、“<”或“=”连接)
(3)在相同条件下,若起始时容器中加入a molA、bmolB和cmolC,要达到t1时刻同样的平衡(各物质的百分含量相同),a、b、c要满足的条件为 。
(含a,b,c的代数式表示)
(10分)(1)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH ,盐酸______(填“<” 、“="”" 或 “>”)醋酸,写出醋酸电离的方程式______________。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈___________(填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)_____________________。
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为____________(填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为__________。
a.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) b.c(Na+) = c(CH3COO-)>c(OH-) =c(H+)
c.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) d.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(2)向盛有1mL 0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是_____________________________,
产生该现象的原因是(用离子方程式或文字表示)_______________________________。
( 13分)西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:
| 分子式 |
结构简式 |
外观 |
熔点 |
溶解性 |
| C12H10ClN3O |
 |
白色结晶粉末 |
170~172°C |
易溶于水 |
(1)氯元素基态原子核外电子的未成对电子数为。
(2)氯吡苯脲的晶体类型为_______,所含第二周期元素第一电离能从大到小的顺序为________________。
(3)氯吡苯脲晶体中,氮原子的杂化轨道类型为_______。
(4)氯吡苯脲晶体中,微粒间的作用力类型有_________。
A.离子键B.金属键C.共价键D.配位键E.氢键
(5)氯吡苯脲熔点低,易溶于水的原因分别为_________________________________
________________________________________________________________________。
(6)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。 异氰酸苯酯 2-氯-4-氨基吡啶氯吡苯脲
异氰酸苯酯 2-氯-4-氨基吡啶氯吡苯脲
反应过程中,每生成1mol氯吡苯脲,断裂_______个σ键、断裂_______个π键
(9分)原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
| A |
B |
C |
D |
E |
F |
|
| 主要化合价 |
-1 |
-3 +5 |
-2 +6 |
-1 +7 |
+2 |
+1 +2 |
| 原子半径 |
0.071 |
0.11 |
0.102 |
0.099 |
0.197 |
0.117 |
(1)B、C、D三种元素第一电离能数值由小到大的顺序是(填元素符号);
(2)B的氢化物中心原子采取杂化,空间构型是形,是分子(填“极性”或“非极性”);
(3)F2+与NH3 形成配离子的结构式为;往某种蓝色溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,可得到含有上述配离子的配合物。写出沉淀溶解的离子方程式。
(4)A 、E两种元素形成晶体晶胞是下图中的(填①、②、③或④);
①②③④
(5)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出C的氢化物所在的折线(填n、m、x或y)。
磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。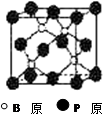
回答下列问题:
(1)上述反应物中含有一种元素,其基态原子具有八种不同能量电子,写出其基态原子的价电子轨道表示式 。
(2)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子。
(3)磷化硼的晶体类型是 ,B原子的杂化方式是 ,每生成1molBP,共形成 molB-P键。
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P B (填“>”、“<”)
(5)BBr3分子中,B原子采取 杂化,键角为
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是
。
( 12分)有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第八列 |
(1)已知BA5为离子化合物,是由、两种微粒构成的(填化学符号)。
(2)B基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了。
(4)G位于族,G3+价电子排布式为。GE3常温下为固体,熔点 ,沸点
,沸点 ,在
,在 以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
(5)DE3 中心原子的杂化方式为,其空间构型为。
(6)前四周期中与F同一族的所有元素分别与E元素形成化合物,其晶体的熔点由高到低的排列顺序为(写化学式),原因是