(10分)(1)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH ,盐酸______(填“<” 、“="”" 或 “>”)醋酸,写出醋酸电离的方程式______________。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈___________(填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)_____________________。
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为____________(填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为__________。
a.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) b.c(Na+) = c(CH3COO-)>c(OH-) =c(H+)
c.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) d.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(2)向盛有1mL 0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是_____________________________,
产生该现象的原因是(用离子方程式或文字表示)_______________________________。
(1)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式:。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 =" —702" kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 =" —182" kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s)△H3= 。
。
(3)已知 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:
①图中A、C分别表示、,
②E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是
③图中△H=kJ·mol-1。
⑴现有一透明的注射器针筒,充满NO2气体(如图甲),当推动活塞时,气体的颜色将(填“变浅”、“变深”、“先变深后变浅”或“先变浅后变深”),当气体体积变为图甲的一半时(如图乙),NO2的浓度(填“大于”、“等于”或“小于”)推压活塞前NO2浓度的2倍。当观察到时,可确定针筒内已经达到了化学平衡状态。当活塞后拉时,通过针筒又吸进少量NO2气体, 再前推活塞固定在图乙位置,NO2的转化率将(填“增大”、“减小”、或“不变”)。
再前推活塞固定在图乙位置,NO2的转化率将(填“增大”、“减小”、或“不变”)。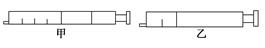
⑵另有一透明的注射器针筒,充满H2、I2、HI气体(如图甲),当推动活塞时,气体的颜色将(填“变浅”、“变深”、“先变深后变浅”或“先变浅后变深”),当气体体积变为图甲的一半时(如图乙,此时I2仍为气体),HI的浓度(填“大于”、“等于”或“小于”)推压活塞前HI浓度的2倍。
如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。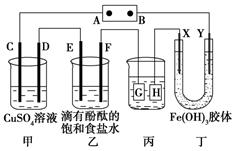
请回答:
(1)B极是电源的 ,一段时间后,甲中溶液颜色,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为。
(3)现用丙装置给铜件镀银,则H应该是(填“镀层金属”或“镀件”),电镀液是溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为,甲中溶液的pH(填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是。
下图是工业生产硝酸铵的流程。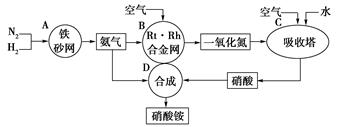
 (1)吸收塔C中通人空气的目的是
(1)吸收塔C中通人空气的目的是
A、B、C、D四个容器中的反应,属于氧化还原反应的是(填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H=-1266.8kJ/mol
N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol
写出氨高温催化氧化的热化学方程式:
(3)已知:N2(g)+3H2(g)  2NH3(g);△H=-92kJ/mol。为提高氢气的转化率,宜采取的措施有。(填字母)
2NH3(g);△H=-92kJ/mol。为提高氢气的转化率,宜采取的措施有。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为25%,此时H2的转化率为 。
(1)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为
________________________________________________。
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为;
又知H2O(l) H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是kJ。
H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是kJ。