乙烯是来自石油的重要有机化工原料。结合以下路线回答: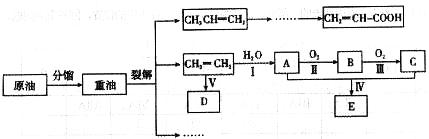
已知:2CH3CHO+O2 2CH3COOH
2CH3COOH
(1)D为高分子化合物,可以用来制造多种包装材料,其结构简式是__________。
(2)E是有香味的物质,实验室制取E的装置如下图所示。
①反应IV的化学方程式是______________________________,该反应类型是__________。
②该装置图中有一个明显的错误是____________________________。
(3)反应II的化学方程式是____________________________。
(14分)X、Y、Z、M、N均为短周期主族元素,原子序数依次增大。Y原子最外层电子数与核外电子总数之比为3:4,M与Y同主族,N﹣、Z+、X+离子的半径逐渐减小,X、N可形成化合物A,常温下A为气体。据此回答:
(1)M在周期表中的位置是__________,Z单质与A的水溶液反应的离子方程式表示为___________。
(2)X、Z、M三种元素可形成酸式盐B,则B的电子式为_______,B中含有的化学键类型是________。
(3)X与Y、M可分别形成含有18个电子的分子C和D,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式_______________
(4)已知通常状况下1 g X2在Y2中完全燃烧放出a kJ的热量。请写出表示X2燃烧热的热化学方程式____
(5)由X、Y、Z、M四种元素组成化合物E在熔融状态下能电离出两种离子,写出E在水溶液中的电离方程式_______________。
[化学——选修5:有机化学基础]可降解塑料PCL的结构可表示为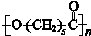 。其合成路线如下。
。其合成路线如下。
已知: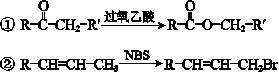
回答下列问题:
(1)B中所含官能团的名称是______。
(2)D的结构简式是______。
(3)M的分子结构中无支链。M生成D的反应类型是______。
(4)E是D的同分异构体,具有相同的官能团。E的结构简式是______。
(5)下列说法正确的是______。
a.K没有顺反异构
b.M在一定条件下可发生聚合反应
c.PCL的结构中含有酯基
(6)H与足量氢氧化钠溶液反应的化学方程式是_。
(7)M的氧化产物己二酸是合成尼龙的原料之一。用B做原料可制得己二酸,请结合相关信息完成其合成路线流程图(无机试剂任选)。______。
已知: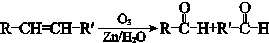
合成路线流程图示例: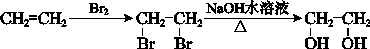
(1)无机化合物可根据其组成和性质进行分类。以下是一组对“一些物质与水反应”的分类图,请按要求填空: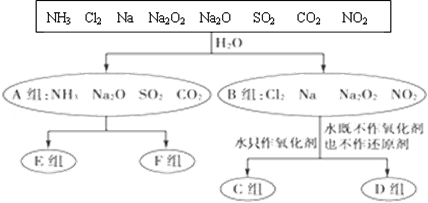
①上述分类中,分成A、B两组的依据是;
②C组物质与水反应的离子方程式为;
③D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶1的物质有(填化学式)。
(2)过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
①上述反应中,H2O2既体现氧化性又体现还原性的反应是________;
②保存过氧化氢的试剂瓶上最适合贴上的一个标签是________(填序号);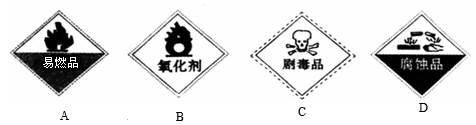
③H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN)。H2O2被称为绿色氧化剂的理由是________________。
(3)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
____CuO+____NH4Cl ____Cu+____CuCl2+____N2↑+____H2O
____Cu+____CuCl2+____N2↑+____H2O
①配平此氧化还原反应方程式;
②此反应中若产生0.2mol的气体,则有________mol的电子转移。
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 |
I1 |
I2 |
I3 |
I4 |
…… |
| Im/kJ·mol-1 |
578 |
1 817 |
2 745 |
11 578 |
…… |
则该元素是_______(填写元素符号)。
(2)锗(Ge)可能的性质或应用有___________。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物HOH2CCH2OH,下列叙述正确的有_______。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D.该分子在水中的溶解度大于2-丁烯
(4)NaF晶体的熔点_________ BF4-的熔点(填>、=或<),其原因是_________。
BF4-的熔点(填>、=或<),其原因是_________。
A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
| 元素 |
有关性质或结构信息 |
| A |
负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B |
B原子得到一个电子后3p轨道全充满 |
| C |
C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D |
D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物水化物的酸性为同主族最强 |
| E |
E元素的核电荷数等于A原子的核电荷数和B元素氢化物的核电荷数之和 |
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B)I1(Y)(填“>”“=”或“<”);
(2)E元素原子的核外电子排布式为__________;
(3)盐X的水溶液呈(填“酸性”“碱性”或“中性”);
(4)C单质分子中σ键和π键的个数比为,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是___________________;
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式:,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:_______________。