(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 |
I1 |
I2 |
I3 |
I4 |
…… |
| Im/kJ·mol-1 |
578 |
1 817 |
2 745 |
11 578 |
…… |
则该元素是_______(填写元素符号)。
(2)锗(Ge)可能的性质或应用有___________。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物HOH2CCH2OH,下列叙述正确的有_______。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D.该分子在水中的溶解度大于2-丁烯
(4)NaF晶体的熔点_________ BF4-的熔点(填>、=或<),其原因是_________。
BF4-的熔点(填>、=或<),其原因是_________。
计算填空:
(1)1mol某金属单质与足量的H2SO4反应,放出1.5molH2(标况下)并转化为具有Ne原子的电子层结构的离子,则该金属在周期表的位置。
(2)(6 分)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
_ aA (g)+ bB (g)  2C(g)
2C(g)
起始物质的量(mol): 3 2 0
2s末物质的量浓度(mol/L): 0.9 0.8 0.4
则①a=,b=;
②2S内B的反应速率=。
(3) 1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式。
(1)某种粒子有1个原子核,核中有8个质子,10个中子,核外有10个电子,该粒子的化学符号(包含质子数、质量数)是。
(2)某分子中有5个原子核,共有10个电子,这种分子的电子式是。
(3)下列变化中,破坏的作用力分别是什么?
食盐加热熔化:;碘升华:。
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用
还原
可得到金属钨,其总反应为:
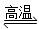
请回答下列问题:
⑴ 上述反应的化学平衡常数表达式为。
⑵ 某温度下反应达平衡时,
与水蒸气的体积比为2:3,则
的平衡转化率为;随温度的升高,
与水蒸气的体积比减小,则该反应为反应(填"吸热"或"放热")。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 |
25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 |
第一阶段反应的化学方程式为;580℃时,固体物质的主要成分为;假设
完全转化为
,则三个阶段消耗
物质的量之比为。
⑷ 已知:温度过高时,
转变为
;
则
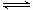 的
。
的
。
⑸ 钨丝灯管中的
在使用过程中缓慢挥发,使灯丝变细,加入
可延长灯管的使用寿命,其工作原理为:
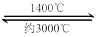 。下列说法正确的有。
。下列说法正确的有。
a.灯管内的
可循环使用
b.
在灯丝上分解,产生的
又沉积在灯丝上
c.
在灯管壁上分解,使灯管的寿命延长
d.温度升高时,
的分解速率加快,
和
的化合速率减慢
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成a-萜品醇G的路线之一如下: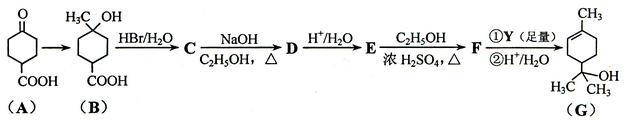
已知:
请回答下列问题:
⑴
所含官能团的名称是。
⑵
催化氢化得
,写出
在一定条件下聚合反应的化学方程式:。
⑶
的分子式为;写出同时满足下列条件的
的链状同分异构体的结构简式:。
① 核磁共振氢谱有2个吸收峰② 能发生银镜反应
(4)
、
的反应类型分别为、。
⑸
的化学方程式为。
⑹ 试剂
的结构简式为。
⑺ 通过常温下的反应,区别
、
和
的试剂是和。
⑻
与
催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物
,写出
的结构简式:。
、
、
、
、
五种元素分属三个短周期,且原子序数依次增大。
、
同主族,可形成离子化合物
;
、
同主族,可形成
、
两种分子。
请回答下列问题:
⑴
在元素周期表中的位置为。
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式),非金属气态氢化物还原性最强的是(写化学式)。
⑶
、
的单质或两元素之间形成的化合物可作水消毒剂的有(写出其中两种物质的化学式)。
⑷
的燃烧热
,写出
燃烧反应的热化学方程式:
⑸
的电子式为;
与水反应放出气体的化学方程式为。
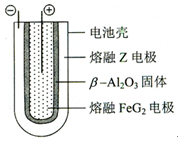
⑹ 熔融状态下,
的单质和
能组成可充电电池(装置示意图如下),反应原理为:
2
+
 ;放电时,电池的正极反应式为:充电时,(写物质名称)电极接电源的负极;该电池的电解质为。
;放电时,电池的正极反应式为:充电时,(写物质名称)电极接电源的负极;该电池的电解质为。