[化学——选修5:有机化学基础]可降解塑料PCL的结构可表示为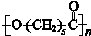 。其合成路线如下。
。其合成路线如下。
已知: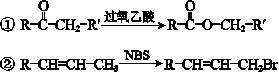
回答下列问题:
(1)B中所含官能团的名称是______ 。
(2)D的结构简式是______ 。
(3)M的分子结构中无支链。M生成D的反应类型是______ 。
(4)E是D的同分异构体,具有相同的官能团。E的结构简式是______ 。
(5)下列说法正确的是______ 。
a.K没有顺反异构
b.M在一定条件下可发生聚合反应
c.PCL的结构中含有酯基
(6)H与足量氢氧化钠溶液反应的化学方程式是_ 。
(7)M的氧化产物己二酸是合成尼龙的原料之一。用B做原料可制得己二酸,请结合相关信息完成其合成路线流程图(无机试剂任选)。______ 。
已知: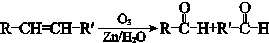
合成路线流程图示例: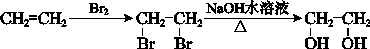
(12分)已知某一反应体系有反应物和生成物共三种物质:FeCl3、FeCl2、Fe。完成下列问题:
(1)该反应中的还原产物的化学式是________,还原剂的化学式是________。
(2)该反应的离子方程式_______________________________。
(3)标出该反应中电子转移的方向和数目。
(4)如果反应中转移了0.3 mol电子,则________(填“溶解”或“生成”)的铁的质量为________。
(8分)如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末。
回答下列问题。
(1)写出A→B的化学方程式。
(2)写出C→D的离子方程式__________________________________。
(3)在B→C的变化中,所得C的溶液往往不纯,其中的杂质(不包括水)可能是________________,主要原因是_________________________________。
(10分)现有下列七种物质:①铝 ②蔗糖③CO2④H2SO4⑤Ba(OH)2⑥红褐色的氢氧化铁胶体⑦HCl
(1)上述物质中属于电解质的有________。(填序号)
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH-====H2O,则该反应的化学方程式为__________________________________________。
(4)⑦的浓溶液与高锰酸钾发生反应的化学方程式为:2KMnO4+16HCl(浓)="===" 2MnCl2+2KCl+5Cl2↑+8H2O,该反应中的氧化剂是_______,氧化产物是。
提供下列四种试剂:①氢氧化钠溶液(质量分数为50%),②浓盐酸、③浓硫酸,取三种金属:铁片、铜片、铝片(表面用砂纸打磨过)做实验:
(1)若要证明三种金属的活动性强弱,可选用的试剂编号为
(2)室温下,将三种金属分别投入上述某种试剂中,均不能观察到明显的现象,试剂的编号是
(3)有一种试剂只能和上述三种金属中的一种发生化学反应,该试剂的编号是,
该反应的氧化剂是
(8分)胃酸(主要成分为盐酸)过多是常见的胃病。甲、乙两种中学课本中用以治疗胃酸过多的常见胃药,以下是它们的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;
(2)能溶于水,水溶液呈弱碱性;
(3)遇酸及酸性药物则产生二氧化碳;
乙:(1)与胃酸是中和作用缓慢而持久,可维持3~4小时。
(2)凝胶本身覆盖于溃疡面上,具有保护作用。
(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是(填中文名称);乙中含有的主要化学成份是(填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的化学方程式:。
(3)试写出乙中含有的主要化学成份分别与稀盐酸和氢氧化钠溶液反应的离子方程式:;。