A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。B元素基态原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素。根据以上信息回答下列问题:
(1)D元素的名称为 ,E的电子排布式为 ;
(2)C、D、F的简单离子中,半径最小的是 (填离子符号);
(3)BA4的空间构型为 ,B、C两元素形成的非极性分子的结构式为 ;
(4)由这六种元素形成的单质和化合物中,可以相互反应生成H2的化学方程式为
,可以相互反应生成O2的化学方程式为
;
(5)下列关于甲和乙的说法中,错误的是 (填序号)
①乙分子中含有非极性键,一定是非极性分子
②甲的沸点较高与分子间形成氢键有关
③甲中中心原子采取sp2杂化
④乙在一定条件下可以分解生成甲
⑤甲分子中极性键的极性向量和为零
Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
| 元素 |
Mn |
Fe |
|
| 电离能(kJ/mol) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
回答下列问题:
(1)Fe元素价电子层的电子排布式为____________,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是________。
(2)Fe原子或离子外围有较多能量相近的空轨道,能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是______________。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为________晶体。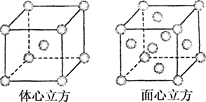
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为_____,其中体心立方晶胞空间利用率为_____________。
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)镍在元素周期表中的位置:_________________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”)。
(3)NiO晶胞中Ni和O的配位数分别为____________、____________。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________。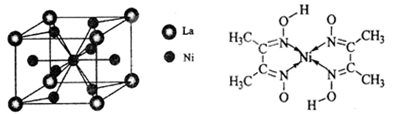
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是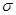 键,碳氮之间的共价键类型是__________,氮镍之间形成的化学键是___________。
键,碳氮之间的共价键类型是__________,氮镍之间形成的化学键是___________。
②该结构中,氧氢之间除共价键外还可存在___________。
③该结构中,碳原子的杂化轨道类型有_______________。
下面的表格是元素周期表的一部分,其中的序号对应的是元素。
| ① |
|||||||||||||||||
| ② |
③ |
④ |
|||||||||||||||
| ⑤ |
⑥ |
⑦ |
⑧ |
||||||||||||||
| ⑨ |
|||||||||||||||||
请回答下列问题:
(1)元素⑨的价电子排布式为___________。
(2)表中某元素最外电子层上p电子数比s电子数少1,该元素的元素符号为___。
(3)②、④、⑤、⑥四种元素的第一电离能由大到小的顺序是(填序号) _________。
(4)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的气态化合物分子的空间构型为_______。
(5)按原子轨道的重叠方式看,元素①③形成的相对分子质量最小的分子中,含_________键;元素⑤和⑧形成的化合物晶体类型为_________。
(普通班做)在2L恒容密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式: ,已知K(300℃)>K(350℃),则该反应正反应为 反应(填“放热”或“吸热”),升高温度,正反应速率 ,(填“增大”“减小”或“不变”)。
(2)图中表示NO2的变化的曲线是______,用氧气表示0—2s内该反应平均反应速率v(O2)= 。
(3)求达平衡时NO的转化率为 。
(4)能说明该反应已经达到平衡状态的是 。
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v(NO)逆=2v(O2)正d.容器内的密度保持不变
(5)能够使该反应的反应速率增大,且平衡向正反应方向移动的是______。
a.及时分离出NO2气体 b.增大O2的浓度
c.适当升高温度d.使用高效催化剂
(实验班做)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g) 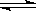 CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=_________________。500℃达平衡时,CH3OH(g)的体积分数为 ,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为 反应(填“放热”或“吸热”)。
(2)500℃该反应的平衡常数为 (保留两位小数),若提高温度到800℃进行,达平衡时,K值 (填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是________________。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积D.使用更有效的催化剂
E.将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0. 5mol/L,则此时v(正) v(逆)(填“>”“<”或“=”)。
(5)下列措施能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度B.在原容器中充入1molHe
C.将水蒸气从体系中分离出D.缩小容器容积,增大压强