(实验班做)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g) 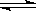 CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=_________________。500℃达平衡时,CH3OH(g)的体积分数为 ,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为 反应(填“放热”或“吸热”)。
(2)500℃该反应的平衡常数为 (保留两位小数),若提高温度到800℃进行,达平衡时,K值 (填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是________________。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂
E.将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0. 5mol/L,则此时v(正) v(逆)(填“>”“<”或“=”)。
(5)下列措施能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。
请按要求回答下列问题:
(1) 写出②的元素名称;
(2) 将④、⑤和⑥三种元素相比较,金属性最强的是(填元素符号);
(3) 元素③的最高价氧化物对应的水化物的化学式为;
(4) 元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式。
A、B、C、D分别表示含有10个电子的离子A或分子,请回答:
(1)A是由五个原子核组成的阳离子,其化学式是;
(2)B是由两种元素组成的双原子阴离子,其电子式是;
(3)C是只含极性键的四原子分子,其结构式是;
(4)D是由两种元素组成的三原子分子,其分子式是___________。
某温度时在密闭容器中A、B、C三种气态物质的物质的量随时间的变化如图所示。则该反应的化学方程式为;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了_________状态。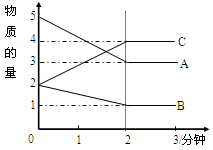
现有如下两个反应:
(A)NaOH + HCl =" NaCl" + H2O(B)2FeCl3 + Cu = 2FeCl2 + CuCl2,
根据两反应本质,判断能否设计成原电池(A)(B)。
能源是影响全球经济和生活的重要因素。目前人类已开发和利用的能源中,氢气是最理想的清洁能源之一。已知反应:2H2+O2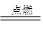 2H2O,试回答下列问题。
2H2O,试回答下列问题。
(1)该反应为反应(填“吸热”或“放热”);
(2) 1当生成8g H2O时,H2O的物质的量是(填字母代号)。
A.1mol B.1mol/LC.1g/mol