某混合溶液中可能含有下列离子中的若干种:K+、Na+、Fe2+、Fe3+、SO42-、NO2—、CO32-,现取三份20mL该溶液进行如下实验:
(1)第一份加入足量盐酸,无任何气体产生
(2)第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
(3)第三份滴加0.10 mol·L—1酸性KMnO4溶液,消耗其体积为VmL
(4)另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
根据上述实验,以下说法正确的是
| A.原混合溶液中只存在Na+、Fe3+、SO42—,不可能存在K+、CO32— |
| B.由实验(1)无法推断原混合溶液中是否含有SO42— |
| C.由实验(2)、(3)可判定原混合溶液中是否含有Fe3+ |
| D.由实验(3)可判定原混合溶液中存在NO2— |
已知HNO3(浓)和S加热生成NO2,该反应的含硫产物肯定不是 ( )
| A.H2S | B.SO2 | C.SO3 | D.H2SO4 |
下列变化一定需要加入还原剂才能实现的是 ( )
A. →CO2 →CO2 |
B.HCl→Cl2 |
| C.KCl→KClO3 | D.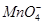 →Mn2+ →Mn2+ |
下列是某学生自己总结的一些规律,其中正确的是
| A.氧化物不可能是还原产物,只可能是氧化产物 |
| B.一种元素可能有多种氧化物,但同一化合价只对应一种氧化物 |
| C.只要能导电的物质就一定是电解质 |
| D.有些化学反应不属于化合、分解、置换、复分解反应中的任何一种反应 |
下列反应(条件均省略)中,反应物中的各种元素都参加了氧化还原反应的是 ( )
| A.2KNO3+S+3C====K2S+N2↑+3CO2↑ |
| B.2KMnO4====K2MnO4+MnO2+O2↑ |
| C.4HNO3====2H2O+4NO2↑+O2↑ |
| D.HgS+O2====Hg+SO2 |
下列反应中,电子转移方向和数目正确的是 ( )
A. |
B. |
C.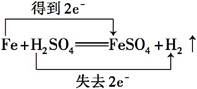 |
D. |