(1)0.3 mol气态高能燃料乙硼烷(分子式为B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,写出上述燃烧反应的热化学方程式:
;
(2)配平下列反应方程式:
□Na2SO3+□KIO3+□H2SO4=□Na2SO4+□K2SO4+□I2+□H2O
V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成气态化合物M的水溶液呈碱性,W的单质在X2中燃烧的产物可使品红溶液褪色,V是一种历史悠久,应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是;写出X、Z两种元素组成的一种化合物的一种用途。
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且属于氧化还原反应,请写出该反应的化学方程式。
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐。常温下该盐的水溶液的pH7(填“大于”、“小于”或“等于”)。
(4)W(s)+O2(g)WO2(g); H1 W(g)+O2(g)
H1 W(g)+O2(g)WO2(g); H2
H2
则 Hl(填“>”或“<”或“=”)
Hl(填“>”或“<”或“=”) H2。
H2。
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式;放电时溶液中H+移向(填“正”或“负”)极。
(6)若将V金属投入到硫酸溶液中,生成了浅绿色溶液N。写出N的溶液与K2Cr2O7酸性溶液反应的离子方程式:。
已知有机物之间能发下如下反应:
下列有机化合物A~H有如下图所示的转化关系: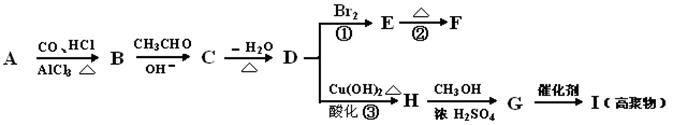
其中,化合物D的分子式为C10H10O,其苯环上的一氯代物只有两种;F的分子式为C10H8O,且所有碳原子在同一平面上。请回答下列问题:
(1)物质I的结构简式。
(2)反应①的反应类型为;反应②的条件为。化合物F的核磁共振氢谱(1H-NMR)显示有个峰。
(3)写出下列反应的化学方程式:
CH3CHO与足量HCHO反应。反应③。
(4)化合物D有多种同分异构体,满足下列条件的有种(一个碳原子上不可能两个双键)
①属于酚类;
②结构中除苯环外无其他环;
③苯环上只有两种互为对位的取代基。
(共14分)已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子。R+核外有28个电子。请回答下列问题(用所对应的元素符号表示)。
(1)R在基态时价层电子排布式为。
(2)写出R单质与A2G2及M最高价氧化物对应水合物反应的离子方程式。
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NGX、G3、等二次污染物。测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n=__(填数字)。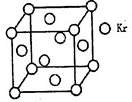
(4)1 mol晶体L中含有σ键的数目为________。
(5)G与M可形成MG3与MG2,MG3分子的空间构型是___,
MG2中M原子的杂化方式___。
(6)在(EA4)2R(MG4)2中存在的化学键除极性键外,还有________(填字母)。
a.离子键b.氢键c.配位键d.金属键
选考【化学——选修3:物质结构与性质】1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等。回答下列问题:
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于____(填“晶体”或“非晶体”)。
(2)基态铜原子的核外电子排布式为____;在CuSO4溶液中滴入过量氨水,形成配合物的颜色为____。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为________;卤素(SCN)2对应的酸有两种,理论推测硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是____。
(4)金属锌晶体的堆积方式为____。在ZnS晶胞中(结构如图1所示),S2-的配位数为____。
(5)铜有两种氧化物CuO、Cu2O,高温时易转化为Cu2O的原因为____(请从原子结构的角度解释)。
(6)铜与金形成的金属互化物结构如图2所示,其晶胞边长为apm,该金属互化物的密度为____g/cm3。(用含a、NA的代数式表示)
用辉铜矿(主要成分为 Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下:
(1)下列措施是为了加快浸取速率,其中无法达到目的的是____(填字母)。
| A.延长浸取时间 | B.将辉铜矿粉碎 |
| C.充分搅拌 | D.适当增加硫酸浓度 |
(2)滤渣I巾的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A可以是_______(填化学式);“赶氨”时,最适宜的操作方法是________。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。