V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成气态化合物M的水溶液呈碱性,W的单质在X2中燃烧的产物可使品红溶液褪色,V是一种历史悠久,应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是 ;写出X、Z两种元素组成的一种化合物的一种用途 。
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且属于氧化还原反应,请写出该反应的化学方程式 。
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐。常温下该盐的水溶液的pH 7(填“大于”、“小于”或“等于”)。
(4)W(s)+O2(g) WO2(g); H1 W(g)+O2(g)
H1 W(g)+O2(g) WO2(g); H2
H2
则 Hl (填“>”或“<”或“=”)
Hl (填“>”或“<”或“=”) H2。
H2。
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式 ;放电时溶液中H+移向 (填“正”或“负”)极。
(6)若将V金属投入到硫酸溶液中,生成了浅绿色溶液N。写出N的溶液与K2Cr2O7酸性溶液反应的离子方程式: 。
氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用, 
(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:。
(2)若已知下列数据:
| 化学键 |
H-H |
N≡N |
| 键能/kJ·mol-1 |
435 |
943 |
试根据表中及图中数据计算N-H的键能kJ·mol-1。
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1,E2______,
△H(填“增大”、“减小”、“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g)= 2N2(g)+6H2O(g) ;△H1=akJ·mol-1
N2(g)+O2(g)=2NO(g);△H2=bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=kJ/mol(用含a、b的式子表示)。
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________热反应,且m+n______p (填“>”、“=”或“<”) 。
(2)减压时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同)
(3)若容积不变加入B,则A的转化率__________,B的转化率__________。
(4)若升高温度,则平衡时B、C的浓度之比将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量__________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________;而维持容器内压强不变,充入氖气时,混合物颜色。(填“变深”、“变浅”或“不变”)
某课题组进行实验研究时,欲配制浓度均为1.0mol•L-1 的Ba(OH)2和H2SO4溶液。
Ⅰ.该组同学在配制Ba(OH)2溶液时,只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(相对分子质量:315),发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。
(1)用化学方程式解释未溶物产生的原因
(2)某同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。据此认为即便使用纯净的Ba(OH)2·8H2O,在室温下也不能配得1.0 mol•L-1Ba(OH)2溶液,其理由是:
Ⅱ.用18 mol•L-1的浓硫酸配制450 mL 1.0 mol•L-1稀硫酸。
(3)实验时,需量取浓硫酸的体积为mL,需用的主要仪器有量筒、烧杯、玻璃棒、、
(4)配制溶液时,定容的操作方法是:
(5)实验中下列情况会使所配溶液浓度偏高的是
| A.洗涤量取浓硫酸的量筒2~3次,并将洗涤液转入容量瓶中 |
| B.定容时仰视刻度线 |
| C.振荡摇匀后再重新加水至刻度线 |
| D.用水洗涤容量瓶未干燥 |
芳香化合物A是一种基本化工原料,可以从煤和石油中得到。A、B、C、D、E的转化关系如下所示: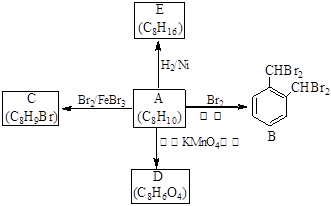
回答下列问题:
(1)A的化学名称是;E属于(填“饱和烃”或“不饱和烃”);
(2)A→B 的反应类型是,在该反应的副产物中,与B互为同分异构体的副产物的结构简式为;
(3)A→C的化学方程式为;
(4)A与酸性KMnO4溶液反应可得到D,写出D的结构简式。
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热某废塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |

(1)试管B收集到的产品中,核磁共振氢谱显示有四个吸收峰的有机物与氢气加成后所得产物的一氯代物有 种。
(2)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。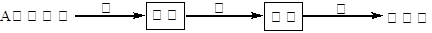
写出反应②的化学方程式。
(3)ZnC2、Al4C3、Mg2C3、Li2C2、Mg3N2等与CaC2和H2O反应相似。请通过对CaC2制C2H2的反应的思考,判断下列反应产物正确的是。
A.ZnC2水解生成乙烷(C2H6) B.Al4C3水解生成甲烷(CH4)
C.Mg2C3水解生成丙炔(C3H4) D.Li2C2水解生成乙烯(C2H4)
E.Mg3N2水解生成氨气(NH3)