氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用, 
(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: 。
(2)若已知下列数据:
| 化学键 |
H-H |
N≡N |
| 键能/kJ·mol-1 |
435 |
943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1。
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1 ,E2______,
△H (填“增大”、“减小”、“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g)= 2N2(g)+6H2O(g) ;△H1=akJ·mol-1
N2(g)+O2(g)=2NO(g); △H2=bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)。
辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol.L-1计算)。
| 离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Mn2+ |
8.3 |
9.8 |
| Cu2+ |
4.4 |
6.4 |
回答下列问题:
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式 。
(2)调节pH的目的是 ,pH的调节范围为_____________。
(3)生成MnCO3沉淀的离子方程式为 。
(4)操作A为 。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2 (g) =2Cu2O(s)+2SO2(g)△H="-" 768.2 kJ.mol-l
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2 (g)△H="+116.0" kJ.mol-l
则由Cu2S与O2加热反应生成Cu的热化学方程式为_____________。
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(NO3)2。假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.0 kg这样的辉铜矿最多能制备 kg无水Cu(NO3)2。
S02的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大S02的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):
(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e所带电量为1.6×10-19C)。
Ⅱ,溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为 。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:
①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因 。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是 。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:
①写出阳极发生的电极反应式 ;
②当电极上有2 mol电子转移时阴极产物的质量为 。
周期表前四周期的元素Q、R、X、Y、Z原子序数依次增大,Q元素的原子形成的离子就是一个质子;R基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;X基态原子s能级的总电子数比p能级的总电子数多1;Y原子的核外成对电子数是未成对电子数的3倍;Z原子的价电子排布为3d74S2。
回答下列问题:
(1)R、X、Y中第一电离能最大的是 (填元素符号),其中Y原子的电子排布式为 。
(2)Q、R元素形成的某分子中共有14个电子,该分子中R原子采取 杂化,该分子的立体构型为 。
(3)RY可以和很多过渡金属形成配合物,如Fe( RY)5、Ni(RY)4。其中Fe(RY)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe (RY)5晶体属于 (填晶体类型)。RY与N2互为等电子体,与RY互为等电子体的离子有 (任写一种)。
(4)向含Z2+的溶液中加入过量的氨水,并通入适量的Y2气体,生成有[Z(NH3)6]3+离子,则该反应的离子方程式为 。
在一容积为4 L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g ) △H<0,反应中NH3的物质的量浓度变化情况如右图:
2NH3(g ) △H<0,反应中NH3的物质的量浓度变化情况如右图: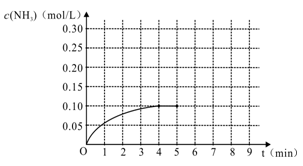
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(H2)为____________mol/(L·min)。
(2)该反应的化学平衡常数表达式K_____________,随温度的升高,K值将 (填“增大”、“减小”“不变”)
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______________。
A. 0.20 mol/L B. 0.12 mol/L C. 0.10 mol/LD. 0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡___________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数___________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
(6)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能对反应的影响,且1>2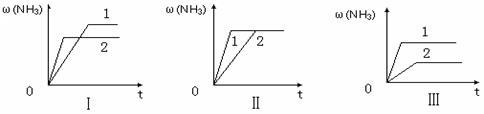
(1)CH3OH是一种可燃性的液体。
已知:① CH3OH (g)+H2O (l)=CO2 (g)+3H2 (g);△H= +93.0KJ·mol-1
② CH3OH (g)+1/2O2 (g)=CO2 (g)+2H2 (g);△H= -192.9KJ·mol-1
③ CH3OH (g)= CH3OH (l);△H= -38.19KJ·mol-1
则表示CH3OH的燃烧热的热化学方程式为
(2)燃料电池是符合绿色化学理念的新型发电装置,CH3OH—空气燃料电池是一种碱性(20%—30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为 。
(3)右图是一个电解过程示意图,假设使用CH3OH—空气燃料电池作为本过程中的电源,其中a为电解液,X和Y是两块电极板。
①若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,Y极板上发生的电极反应式为: 。
②若X、Y分别为石墨和铜,a为CuSO4溶液,铜片的质量变化128g,则CH3OH一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积分数为20%)
(4)已知高锰酸钾能氧化甲醇,也能氧化草酸。查阅资料,乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸。
①请配平该反应的离子方程式:
______MnO4-+______H2C2O4+______===____Mn2++______CO2↑+______。
②某兴趣小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,形成的溶液中各离子的浓度由大到小的顺序为___________________(用离子符号表示)。