已知CH4(g)+2O2(g)== CO2(g)+2H2O(l);ΔH=-Q1kJ·mol-1,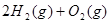 =2H2O(g);△H2=-Q2 kJ·
=2H2O(g);△H2=-Q2 kJ·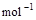 ,
,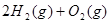 =2H2O(l);△H3=-Q3 kJ·
=2H2O(l);△H3=-Q3 kJ·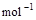 。
。
常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为 。
为了对某工厂排出的废水水质进行监测,某化学实验室取500 mL水样进行检测。当向其中加入KSCN溶液时,水样变红,再向水样中加入铁粉1.12g时,红色恰好褪去。则:
(1)水样中一定存在的金属离子是。
(2)加入铁粉后发生反应的离子方程式为。
(3)加入铁粉前水样中该金属离子的物质的量浓度为。
(1)我国晋代炼丹家葛洪所著《抱朴子》中记载有“以曾青涂铁,铁赤色如铜”[即:曾青(CuSO4)与铁反应生成铜]。试写出该反应的离子方程式:。
(2)铜器表面有时会生成铜绿[CU2(OH)2CO3],这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物的化学方程式:。
(3)工业上常用铝热反应产生的“铁水”来焊接铁轨,请写出铝热反应的化学方程式:。
从海水中可提取多种化工原料,下面是某化工厂对海水的几项综合利用流程图: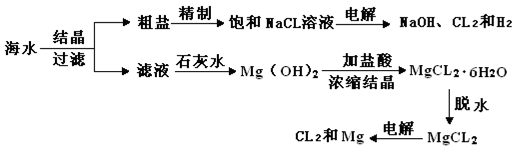
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序中正确的是(填字母)。
| A.①②③④ | B.②③④① | C.②④③① | D.③④②① |
(2)为了降低生产成本,可用海滩上含CaCO3的贝壳制备Ca(OH)2,有关反应的化学方程式为
(3)写出电解饱和NaCl溶液的化学方程式:
煤干馏制得的煤焦油中含一种烃A,A的相对分子质量为128,则其分子式可能是________或________。若A是易升华的块状晶体(芳香烃),则其结构简式可能为________。
为除去粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)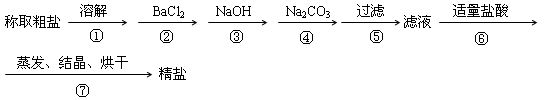
(1)判断BaCl2已过量的方法是
(2)在第⑥步中,写出所有反应的化学方程式