某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热某废塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |

(1)试管B收集到的产品中,核磁共振氢谱显示有四个吸收峰的有机物与氢气加成后所得产物的一氯代物有 种。
(2)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。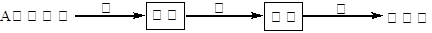
写出反应②的化学方程式 。
(3)ZnC2、Al4C3、Mg2C3、Li2C2、Mg3N2等与CaC2和H2O反应相似。请通过对CaC2制C2H2的反应的思考,判断下列反应产物正确的是 。
A.ZnC2水解生成乙烷(C2H6) B.Al4C3水解生成甲烷(CH4)
C.Mg2C3水解生成丙炔(C3H4) D.Li2C2水解生成乙烯(C2H4)
E.Mg3N2水解生成氨气(NH3)
(12分)己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大。X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍,试回答下列问题:
(1)YW2的电子式;Z的氢化物结构式为;
写出U元素在周期表中的位置。
(2)离子半径:N+W2-(填>、<或=);
(3)写出Y2X4与V元素的单质在水溶液中反应的化学方程式是。
(4)由N、W组成A2B2型的一种化合物,该物质属于(填“离子”或“共价”)化合物。
(6分)现有CH4、C2H4、C6H6三种有机物:
(1)等质量的三种气体完全燃烧时生成水最多的是________;
(2)同状况、同体积的三种气体完全燃烧时耗去O2的量最多的是________。
(3)在150℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是________。
(6分)完成下列化学反应方程式并注明反应类型。
1、乙烯与水一定条件下反应
2、甲烷与氯气光照条件下反应(只写第一步)
3、苯与浓硝酸,浓硫酸一定条件下反应
下列各组物质①O2和O3②12C和14C ③CO(NH2)2和NH4CNO④CH3CH2CH2CH3和(CH3)2CHCH3
⑤CH2=CH2和CH3CH=CH2⑥CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)C2H5
互为同系物的是__________,互为同分异构体的是_____________
互为同位素的是______,互为同素异形体的是_________,
是同一物质的是__________。
I.已知拆开1mol H—H键,1mol N三N键分别需要吸收的能量为436kJ,946kJ;形成1mol N—H键,会放出能量391kJ,在反应N2 + 3H2="=" 2NH3中,每生成2mol NH3 ____热量(填:吸收或放出)_____kJ。
II.(6分)我国经济发展对能源的需求与日俱增。一种新型燃料电池是将两根特制电极插入氢氧化钾溶液中,然后从两极分别通入甲烷和氧气,其电极反应式为:
X极:CH4+10OH- -8e- ="=" CO32-+7H2O Y极:4H2O+2O2+8e- ==8OH-
(1)指出该电池的正极__________(X或Y)极
(2)在标准状况下,通入5.6L甲烷气体,完全反应后有__________mol电子转移;
(3)该电池的电解质溶液的PH变化是_______ ___(填升高、降低、不变)
III.(6分)利用Cu + 2FeCl3 = CuCl2 + 2FeCl2反应,设计一个原电池。
(1)画出装置图(在图中标出电极材料、正负极、电解质溶液)。
(2)写出电极反应方程式
负极: 正极: