⑴、下列说法正确的是 (填序号)。
①油脂水解可得到氨基酸和甘油
②水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精;
③由于胶粒的直径比离子大,所以淀粉溶液中混有的碘化钾可用渗析法分离;
④制乙酸乙酯时,把乙醇和乙酸依次加入浓硫酸中
⑤淀粉水解后,取部分溶液加入碘水,溶液变蓝,说明淀粉未水解。
⑥不慎把苯酚溶液沾到了皮肤上,应立即用酒精洗涤。
⑦少量稀溴水滴入苯酚溶液中制备2,4,6-三溴苯酚。
⑧用浓氨水洗涤做过银镜反应的试管
⑨配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止
⑩蔗糖水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖
⑵甲醇、乙醇、丙醇均能与水以任意比混溶,原因是
⑶、写出五种化学性质不同,且在同类物质中分子量最小的有机物的结构简式,这些物质燃烧
V(CO2):V(H2O)=1:1,这些物质是__________、____________、____________、____________、___________。
⑷ 写出蔗糖水解的方程式
某种牙膏中的摩擦剂是碳酸钙,可以用石灰石(含杂质SiO 2)来制备。某同学甲设计了一种制备碳酸钙的方案,其流程图为:
2)来制备。某同学甲设计了一种制备碳酸钙的方案,其流程图为: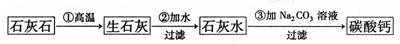
请回答下列问题:
(1)假设第①步反应完全进行,则第②步反应过滤后得到的滤渣的成分为 。
(2)第③步反应不使用CO2,其主要原因是(用离子方程式表示)
。
(3)第③步反应使用Na2CO3而不使用NaHCO3,从提高企业经济效益的角度考虑,其原因是 。
(4)某同学乙用石灰石为原料(其他试剂自选),设计了另一种制备碳酸钙的实验方案,请你完成他的实验方案。
乙同学所设计的方案的优点是 。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·xH2O的化学方程式为_______________________________。
⑵检验TiO2·xH2O中Cl-是否被除净的方法是______________________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。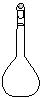

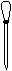
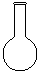
a b cd e
⑸滴定终点的现象是___________________________________________________。
⑹滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g, 消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,震荡,这时候,观察到的现象是___________________________;
(2) 某学生在一次分液操作中发现溶液都是无色液体,无法知道分液漏斗中的液体哪一层是有机层,哪一层是水层,请你用简单的方法帮他鉴别出来,写出有关步骤及判断依据:。
(3)上面实验中用到一定物质的量浓度的稀硫酸,现用浓硫酸配制该稀硫酸,下面操作造成所配稀硫酸溶液浓度偏高的是_____________
| A.溶解的时候溶液没有冷却到室温就转移 |
| B.转移时没有洗涤烧杯、玻璃棒 |
| C.向容量瓶加水定容时眼睛俯视液面 |
| D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶 |
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
(1)写出以下两种仪器的名称: A:
A: B:
B:
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,烧杯的实际质量为_________g.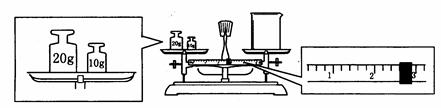
(3)指出下面实验中存 在的错误:
在的错误:
用0.14mol·L-1 的NaOH溶液测定未知浓度的H2SO4溶液,其实验步骤如下:
(1)配制稀H2SO4溶液取10.00 mL 待测H2SO4溶液,配成1.00 L稀H2SO4溶液。在配制过程中,应选用下列仪器中的(用序号填空)。
1烧瓶2锥形瓶3容量瓶4烧杯5酸式滴定管6漏斗7玻璃棒8胶头滴管9量筒
(2)滴定用酸式滴定管取稀释后硫酸溶液20.00 mL,注入中,再滴入几滴酚酞试液,摇匀后,用0.14mol·L-1 的NaOH溶液进行滴定,直至加入最后一滴NaOH溶液时,恰好使溶液即可停止滴定。
(3)计算
根据上图所示0.14mol·L-1 的NaOH溶液的用量,计算稀释前后H2SO4溶液的物质的量浓度。
(4)碱式滴定管在注入0.14mol·L-1 的NaOH溶液之前,用水冼净之后,立即装入0.14mol·L-1 的NaOH溶液,其结果将会使测得的H2SO4溶液的物质的量浓度(填“偏高”、“偏低”或“无影响”)。
(5)滴定前,盛稀释后H2SO4溶液的容器用水冼净后,用H2SO4溶液润冼,再准确量取20.00 mL 稀释后的H2SO4溶液,并滴入数滴酚酞试液,然后用NaOH溶液滴定。其结果将会使测得的H2SO4溶液的物质的量浓度(填“偏高”、“偏低”或“无影响”)。
(6)滴定前,碱式滴定管内无气泡,在滴定结束时,管内进入气泡。记录消耗NaOH溶液体积时,未赶走气泡,结果将会使测得的H2SO4溶液的物质的量浓度(填“偏高”、“偏低”或“无影响”)。