(1)t℃时,将2molSO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2 (g)+O2 (g) 2SO3 (g);ΔH=-196kJ·mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
2SO3 (g);ΔH=-196kJ·mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
②从反应开始至达到化学平衡,生成SO3平均反应速率为 ;该条件下反应的平衡常数K= (精确到小数点后两位)
③反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气
④上述反应达平衡后,判断下列情况下平衡移动的方向(填“向右”、“向左”或“不移动).
再通入1.6molSO2、0.8molO2、0.4molSO3, ;再通入0.2molSO2、0.2molSO3,_____
(2)工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将 (填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将______ 。
直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理。
⑴利用钠碱循环法可脱除烟气中的SO2。
①用化学方程式表示SO2形成硫酸型酸雨的反应:
。
②在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反
应的离子方程式是_________ 。
⑵处理氮氧化物的方法很多,以下列举几种常见方法。
①用过量NaOH溶液吸收NO2气体。所得溶液中除含有NaOH和NaNO2,还含有
。
②为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。写出净化过程中的总化学反应方程式:
。
③用氨气可以将其转化为无害气体,发生的 反应为:6NOx+4xNH3=(3+2x)N2+6xH2O。某工厂排出的尾气中NOx的含量为0.56%(体积分数), 若处理1×104L(标准状况)该尾气需42.5gNH3,则x= 。
下表是元素周期表的一部分,回答下列有关问题: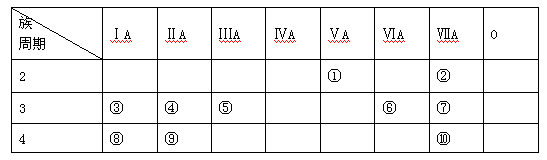
⑴在这些元素中,某元素的氧化物既可作漂白剂又是空气质量的监测对象,该元素是(填写序号)。
⑵在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式),呈两性的氢氧化物是(填化学式);写出两者反应的离子方程式。
⑶请写出工业上①的氢化物发生催化氧化的化学方程式_________________。
⑷在③与④中,化学性质较活泼的是(填元素符号),证明该结论的化学实验是。
化学科学在药物的开发、合成和使用中起着至关重要的作用。如小苏打、氢氧化铝、三硅酸镁等可治疗胃酸过多,试回答下列问题:
(1)写出小苏打与胃酸(主要成分为稀盐酸)作用的离子方程式:
。
(2)现有一瓶胃舒平药片(复方氢氧化铝),请写出其与胃酸(主要成分为稀盐酸)反应的离子方程式。
对于混合物的分离或提纯,常采用的方法有:①过滤,②蒸发,③蒸馏,④分液,下列各组混合物的分离或提纯应采用什么方法?(要求:填序号)
(1)________分离饱和食盐水和沙子的混合物
(2)________分离水和苯的混合物
(3) ________分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物
按以下装置图进行实验,填写有关现象及化学方程式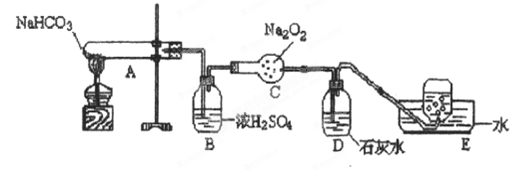
①A中现象是____________________
②B中浓硫酸的作用是____________________
③C中发生反应的化学方程式为____________________
④D中现象是____________________,反应的化学方程式是______________
⑤E中收集的气体是____________________