下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。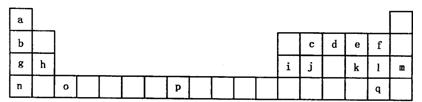
试回答下列问题:
(1)请写出元素o的基态原子电子排布式 ,g元素的价电子的四个量子数依次是 。
(2)d的氢化物中心原子的杂化方式是 。
(3)o元素所在族的符号是 。
(4)d的氢化物与l的氢化物反应后的产物中包含的化学键是 。
(5)f、l、q的氢化物中沸点最高的是 。(写化学式)
(6)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同。则j晶体的熔点 jc晶体的熔点(填“大于”“等于”“小于”)原因是
(14分)(1)448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为
(2)12.4gNa2R中含Na+0.4mol,则Na2R的摩尔质量为,R的相对原子质量为
(3)5molCO2的质量是_________;在标准状况下所占的体积约为__________;所含的分子数目约为____________________;所含氧原子的数目约为___________________。
根据图示填空。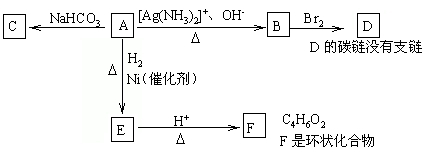
(1)化合物A含有的官能团是_________________。
(2)1molA与2molH2反应生成1molE,其反应方程式是__________________。
(3)与A具有相同官能团的A的同分异构体的结构简式是___________________。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是_____________________。
(5)F的结构简式是__________。
有机物A的分子式为C3H6O2,它与NaOH溶液共热,得到含B的蒸馏物。将B与浓硫酸混合加热,控制温度可以得到一种能使溴水褪色,并可做果实催熟剂的无色气体C。B在有铜存在时加热,可被空气氧化成D,D与新制的Cu(OH)2悬浊液加热煮沸,有红色沉淀和E生成。
(1)写出下列物质的结构简式:
A BC
DE
(2)B与浓硫酸混合加热得到气体C的化学方程式,该反应的反应类型为。
(3)B在有铜存在时加热,被空气氧化成D反应方程式
医药阿斯匹林的结构简式如图1所示: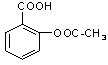
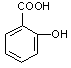
图1图2
试根据阿斯匹林的结构回答;
(1)(3分)阿斯匹林看成酯类物质,口服后,在胃肠酶的作用下,阿斯匹林发生水解反应,生成A和B两种物质。其中A的结构简式如图2所示,则B的结构简式为;B中含有的官能团是。
(2)阿斯匹林跟小苏打同时服用,可使上述水解产物A与小苏打反应,生成可溶性盐随尿液排出,此可溶性盐的结构简式是。
(3)上述水解产物A与氢氧化钠溶液反应的化学方程式为
;
(4)上述水解产物B与乙醇、浓硫酸共热反应的化学方程式为
。
按要求填空:
(1)用系统命名法命名下列物质
①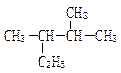 __
__
②
(2)写出下列有机物的结构简式:
① 2,6-二甲基-4-乙基辛烷:;
② 2-甲基-1-戊烯:;
(3)(2分)下列各组中的两种有机物,可能是相同的物质、同系物或同分异构体等,请判断它们之间的关系
①2-甲基丁烷和丁烷 ________________;
②2-甲基丁烷和2,2-二甲基丙烷___________________。