下列除杂的操作方法,正确的是
| A.NH3中混有少量水蒸气:通过装有浓硫酸的洗气瓶 |
| B.CO2中混有少量SO2气体:通入NaOH溶液 |
| C.食盐固体中混有少量NH4Cl:加热 |
| D.硝酸混有少量硫酸:加适量BaCl2溶液后再过滤 |
下列离子方程式书写正确的是
| A.向明矾溶液中加入过量的氢氧化钡溶液: Al3+ + 2SO42- +2Ba2+ + 4OH- →2BaSO4↓+ AlO2- + 2H2O |
B.碳酸钠溶液中 通入少量二氧化碳气体:CO32—+CO2+H2O→2HCO3— 通入少量二氧化碳气体:CO32—+CO2+H2O→2HCO3— |
C.醋酸钠水溶液中通入足量CO2:2CH3C OO— + CO2 + H2O→ 2CH3COOH + CO2— 3 OO— + CO2 + H2O→ 2CH3COOH + CO2— 3 |
| D.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合 |
Ca2++2HCO3—+2OH—→CaCO3+CO32—+2H2O
对实验Ⅰ~Ⅳ的实验现象预测正确的是
| A.实验Ⅰ:液体分层,下层呈无色 |
| B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解 |
| C.实验Ⅲ:试管中溶液颜色变为红色 |
| D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
一定条件下磷与干燥氯气反应,若0.25 g磷消耗掉314mL氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于
| A.1:2 | B.2:3 | C.3:1 | D.5:3 |
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
 |
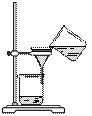 [来 [来 |
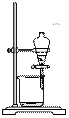 |
 |
|
|
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中不正确的是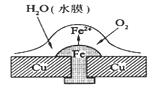
| A.正极电极反应式为:2H++2e→H2↑ |
| B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2→4Fe(OH)3 |
| C.此过程中铜并不被腐蚀 |
| D.此过程中电子从Fe转移向Cu |