某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
| 阳离子 |
K+ Cu2+ Fe3+ Al3+ Ag+ |
| 阴离子 |
I- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,呈紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清。
Ⅲ.另取溶液加入BaCl2溶液,有白色沉淀生成,加稀硝酸沉淀无变化。
请推断:
(1)由Ⅰ判断,溶液中一定含有的阳离子是 (写离子符号)。
(2)Fe3+是否存在? ,判断的理由是
。
(3)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。
将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为
_______________________________________________________________
(4)甲同学最终确定原溶液中所含阳离子是  ,阴离子是 。(写离子符号)
,阴离子是 。(写离子符号)
(5)另取100mL原溶液,加入足量的氨水,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为  g。
g。
(12分)已知: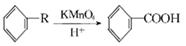 ,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z。F和E按1:2反应生成W,W和Z互为同分异构体。
,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z。F和E按1:2反应生成W,W和Z互为同分异构体。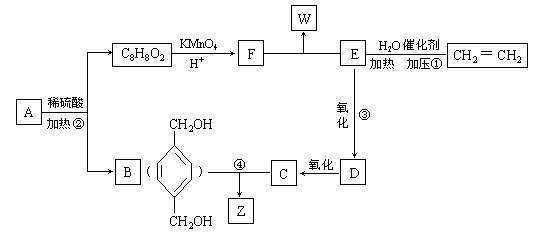
回答下列问题:
(1)写出反应类型:①_____________________,②______________________________。
(2)写出下列反应的化学方程式:
③_____________________________________________________;
④_____________________________________________________。
(3)与B互为同分异构体,属于酚类且苯环上只有两个互为对位取代基的化合物有4种,其结构简式为_______________,_________________,_______________,______________。
(4)A的结构简式可能为_______________________________________(只写一种即可)。
(12分)铜及其化合物在生产生活中有着广泛的应用,铜在化合物中的常见化合价有+1、+2。
(1)工业上可用Cu2S+O2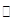 2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
(2)将少量铜丝放人适量的稀硫酸中,温度控制在50℃-60℃,加入H2O2,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:__________________________。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式___________________________。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:
Cu+H2SO4 ________________________________________________。
________________________________________________。
②乙同学认为:黑色固体除CuO外,还可能含有Cu2S和CuS,其理由可能是____(填字母)。
a. Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价升高与S的化合价降低有多种可能
(8分)下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题。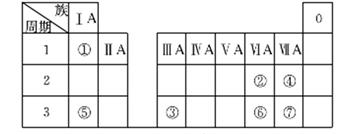
(1)④、⑤、⑦的原子半径由大到小的顺序为______________(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为________>__________。
(3)④、⑥、⑦的气态氢化物的稳定性由弱到强的顺序是_______________。
(4)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式_______________________。
(6分)有一瓶无色溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、I-、Cl-、NO3-、CO32-、SO42-取该溶液进行以下实验:
①该溶液可使pH试纸呈红色;
②取少量溶液加新制氯水及CCl4振荡,可见CCl4层呈现紫色;
③取少量溶液加氯化钡溶液,有白色沉淀生成,加人HNO3后沉淀不溶解;
④取实验③之上层清液,加入硝酸银溶液有白色沉淀生成,加入HNO3后沉淀不溶解;
⑤取少量原溶液加入NaOH溶液呈碱性,在此过程中有白色沉淀生成,而后又逐渐消失,将此溶液加热,有无色气休放出,该气体能使润湿的红色石蕊试纸变蓝。
根据上述实验事实,溶液中肯定存在的离子有_____________,肯定不存在的离子有___________,不能确定是否存在的离子有_________________________。
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中,配制溶液肯定不需要的是__________________________ (填序号),配制上述溶液还需用到的玻璃仪器有(填仪器名称)。
②配制0.1 mol/L NaOH溶液时,其正确的操作顺序是(字母表示,每个字母只能用一次)。
| A.将容量瓶盖紧,振荡,摇匀 |
| B.改用胶头滴管加水,使溶液凹面恰好与刻度线相切 |
| C.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处 |
| D.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
E.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
F.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③配制0.1 mol/L NaOH溶液时,在实验中其他操作均正确,若定容时仰视容量瓶刻度线,则所配溶液浓度0.1 mol/L(填“大于”、“等于”或“小于”)。
④配制0.5 mol/L硫酸溶液500 mL时,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为mL(计算结果保留一位小数)。
⑤配制0.5 mol/L硫酸溶液时,在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所配溶液浓度0.5 mol/L(填“大于”、“等于”或“小于”)。