某气态烷烃和乙烯等体积混合时,1体积混合气体完全燃烧消耗同温同压下4.75体积氧气。试回答:
(1)该烷烃的分子式为 ;
(2)该烷烃所有同分异构体的结构简式为 。
有一瓶澄清的溶液,其中可能有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Cl-、I-、NO3-、CO32-、S2-、SO42-、AlO2-、MnO4-,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性,可以排除________离子的存在;
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫色,可以排除________离子的存在;
(3)另取出部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则又可以排除________离子的存在;
(4)取出部分上述碱性溶液滴加Na2CO3溶液后,有白色沉淀生成,证明________离子存在,又可排除________离子的存在;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。根据上述实验事实确定:该溶液中肯定存在的离子是________,还不能确定是否存在的离子是________。
有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行实验:
| 实验步骤 |
实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊试液 |
溶液变红 |
| (2)取少量该溶液加热,加Cu片和浓H2SO4,加热 |
有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 |
有白色沉淀 |
| (4)取(3)中上层清液,加AgNO3溶液 |
有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 |
有白色沉淀,NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有________,溶液中肯定存在的离子是____。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论)_____。
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。若某氮化铝中含有碳或氧化铝中的一种,现用图I中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应:AlN+NaOH+H2O=NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。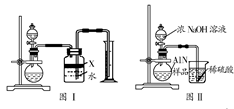
(1)实验有关操作为:a.往烧瓶中放入适量的AlN样品:b.从分液漏斗往烧瓶中加入过量的浓NaOH溶液:c.检验装置的气密性;d.测定收集到水的体积。
正确的操作顺序为:。
(2)本实验中(图Ⅰ)检查装置气密性的方法是:。
(3)广口瓶中的试剂X可选用(填选项前的标号)。
| A.汽油 | B.酒精 | C.植物油 | D.CCl4 |
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是。
(5)若实验中测得样品的质量为w g,氨气的体积为a L(标况下),则样品中AlN的质量分数为:。
(6)有人改用图Ⅱ装置进行同样实验,通过测定烧杯中硫酸增加的质量来确定样品中AlN的质量分数。你认为是否可行?(填“可行”或“不可行”),原因是。
某研究小组测量菠菜中草酸及草酸盐的含量(以C2O42-计)。实验步骤如下:
①将菠菜样品预处理后,热水浸泡,过滤得到含有草酸及草酸盐的溶液。
②调节溶液的酸碱性,滴加足量CaCl2溶液,产生白色沉淀;加入足量醋酸,使CaCO3溶解;过滤得到CaC2O4固体。
③用稀HCl溶解CaC2O4并加水配制100 mL溶液。每次准确移取25.00 mL该溶液,用0.0100 mol·L-1 KMnO4标准溶液滴定,平均消耗标准溶液V mL。
回答下列问题:
(1)步骤①中“样品预处理”的方法是(A.灼烧成灰,B.研磨成汁)。
(2)步骤②中“调节溶液的酸碱性”至(A.弱碱性,B.弱酸性,C.中性)。验证CaCl2溶液已“足量”的操作和现象是。
(3)步骤③中用到的玻璃仪器除烧杯、锥形瓶、胶头滴管、玻璃棒外,还有。
硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1)步骤②加入过量H2O2的目的是。
(2)步骤③中反应的离子方程式为。
(3)步骤④中的一系列操作依次为:过滤、、灼烧、、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为g(用含a的代数式表示,不用化简)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。反应原理为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需要的玻璃仪器为;
②上述实验中的KMnO4溶液需要酸化,可用于酸化的酸是。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸