工业制硫酸铜不是直接用铜和浓硫酸反应,而是将粗铜(含少量银)浸入稀硫酸中,并不断从容器下部吹入细小的空气泡。有关该制备方法的叙述中,不正确的是
| A.该方法应用了原电池工作原理 | B.该方法不产生污染大气的二氧化硫 |
| C.该方法提高了硫酸的利用率 | D.该方法提高了铜的利用率 |
右图为元素周期表中短周期的一部分,下列说法正确的是
| A.非金属性:Y>Z>M |
| B.离子半径:M->Z2->Y- |
| C.ZM2分子中各原子的最外层均满足8电子稳定结构 |
| D.三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
将磁性氧化铁放入稀HNO3中可发生如下反应:
3Fe3O4+28HNO3= 9Fe(NO3)x+NO↑+14H2O,下列判断合理的是
| A.Fe(NO3)x中的x为2 |
| B.稀HNO3在反应中只表现氧化性 |
| C.磁性氧化铁中的所有铁元素全部被氧化 |
| D.反应中每还原0.3mol氧化剂,就有0.9mol电子转移 |
下列有关说法正确的是
A.含有大量 的溶液中:K+、 的溶液中:K+、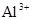 、 、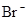 、 、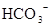 可共存 可共存 |
B.CO(g)的燃烧热是283.0kJ·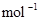 ,则 ,则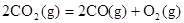 反应的 反应的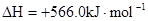 |
| C.用NaOH溶液雕刻工艺玻璃上的纹饰 |
D.在某钠盐溶液中含有等物质的量的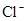 、 、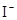 、 、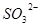 、 、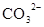 、 、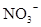 、 、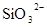 中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有 中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有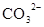 |
在常温常压下,向100mLCH4和Ar的混合气体中通入400mLO2,点燃使其完全反应,最后在相同条件下得到干燥气体450mL,则反应前混合气体中CH4和Ar的物质的量之比为
| A.1:4 | B.1:3 | C.1:2 | D.1:1 |
正确表示下列反应的离子反应方程式为
| A.NH4HCO3溶于过量的浓KOH溶液中并加热: NH4++ HCO3-+2OH-△CO32-+ NH3↑+2 H2O |
| B.Fe溶于硝酸:Fe+2H+﹦Fe2++H2↑ |
| C.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓ |
| D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O |