纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,过滤、水洗除去其中的Cl—,再烘干、焙烧除去水分得到粉体TiO2 。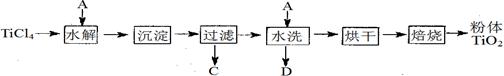
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定T i3+至全部生成Ti4+。请回答下列问题:
i3+至全部生成Ti4+。请回答下列问题:
⑴ TiCl4水解生成TiO2·x H2O的化学方程式为________________________________。
⑵ 检验TiO2·x H2O中Cl—是否被除净的方法是______________________________。
⑶ 下列可用于测定TiO2粒子大小的方法是________________(填字母代号)。
a.滴定法 b.重量法 c.排液量气法 d.透射电子显微镜法
⑷ 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_____________________;使用的仪器除天平、药匙、玻璃棒、烧 杯、量简外,还需要下图中的_________(填字母代号)。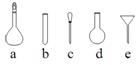
⑸ 滴定Ti3+时的离子方程式为______________________________________;
滴定终点的现象是_________________;该现象的离子方程式________________。
⑹ 称取 TiO2(式量为M)试样w g,配成100mL溶液,取出25mL,进行滴定分析,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL。TiO2质量分数表达式为_________________。
TiO2(式量为M)试样w g,配成100mL溶液,取出25mL,进行滴定分析,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL。TiO2质量分数表达式为_________________。
⑺ 下列操作会导致TiO2质量分数测定结果偏高的是___________。
a、滴定终点读取滴定管刻度时,俯视标准液液面。
b、配制标准溶液时,烧杯中的NH4Fe(SO4)2溶液有少量溅出。
c 、容量瓶清洗之后,未干燥。
、容量瓶清洗之后,未干燥。
d、配制标准溶液定容时,俯视刻度线。
无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为。
(2)工业上用铝土矿(主要成分为
,含有
、
等杂质)制取无水氯化铝的一种工艺流程示意如下: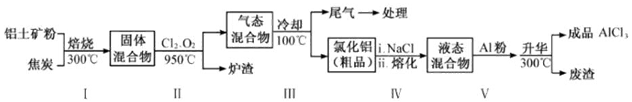
已知:
| 物质 |
|
|
|
|
| 沸点/℃ |
57.6 |
180(升华) |
300(升华) |
1023 |
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是。
③已知:
(
)+
(
)=
(
)+
(
)
="+1344.1
-1
(
)=
(
)+
(
)
="+1169.2
-1
由
、
和
反应生成
的热化学方程式为。
④步骤Ⅲ经冷却至室温后,气体用足量的
冷溶液吸收,生成的盐主要有3种,其化学式分别为。
⑤结合流程及相关数据分析,步骤V中加入铝粉的目的是。
某研究小组将纯净的
气体通入0.1
的
溶液中,得到了
沉淀,为探究上述溶液中何种微粒能氧化通入的
,该小组突出了如下假设:
假设一:溶液中的
假设二:溶液中溶解的
(1)验证假设一
该小组涉及实验验证了假设一,请在下表空白处填写相关实验现象
| 实验步骤 |
实验现象 |
结论 |
| 实验1:在盛有不含
的25
0.1
溶液的烧杯中,缓慢通入纯净的
气体 |
假设一成立 |
|
| 实验2:在盛有不含
的25
0.1
溶液的烧杯中,缓慢通入纯净的
气体 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的
随通入
积的变化曲线入下图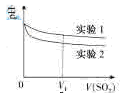
实验1中溶液
变小的原因是;
时,实验2中溶液
小于实验1的原因是(用离子方程式表示)。
(3)验证假设二
请设计实验验证假设二,写出实验步骤,预期现象和结论。
| 实验步骤、预期现象和结论(不要求写具体操作过程) |
(4)若假设二成立,请预测:在相同条件下,分别通入足量的 和 ,氧化相同的 溶液(溶液体积变化忽略不计),充分反映后两溶液的 前者(填大于或小于)后者,理由是
某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一)碘含量的测定
取0.0100
标准溶液装入滴定管,取100.00
海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(
) 反映溶液中
的变化,部分数据如下表:
| 15.00 |
19.00 |
19.80 |
19.98 |
20.00 |
20.02 |
21.00 |
23.00 |
25.00 |
|
| -225 |
-200 |
-150 |
-100 |
50.0 |
175 |
275 |
300 |
325 |
实验(二)碘的制取
另制海带浸取原液,甲、乙两种实验方案如下: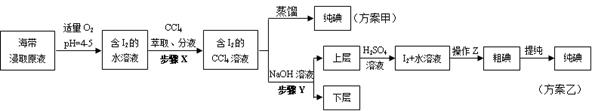
已知:
。
请回答:
(1)实验(一) 中的仪器名称:仪器
, 仪器
。
(2)①根据表中数据绘制滴定曲线:
②该次滴定终点时用去
溶液的体积为
,计算得海带中碘的百分含量为%。
(3)①分液漏斗使用前须检漏,检漏方法为。
②步骤
中,萃取后分液漏斗内观察到的现象是。
③下列有关步骤
的说法,正确的是。
A.应控制
溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.
溶液可以由乙醇代替
④实验(二) 中操作
的名称是。
(4)方案甲中采用蒸馏不合理,理由是。
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水
、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%
溶液洗涤。 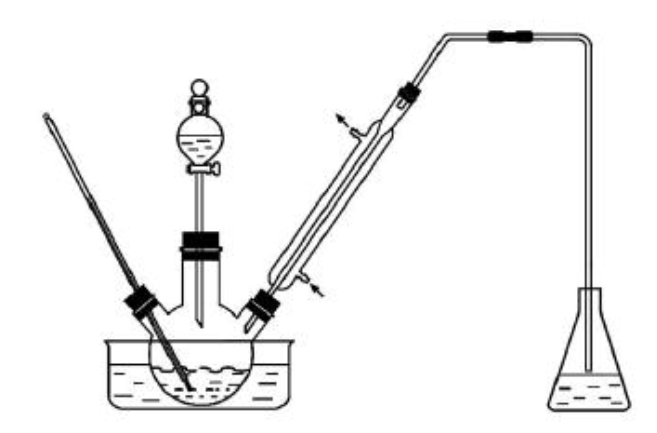
步骤3:经洗涤的有机相加入适量无水
固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是,锥形瓶中的溶液应为。
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为。
(3)步骤2中用10%
溶液洗涤有机相,是为了除去溶于有机相的(填化学式)。
(4)步骤3中加入无水
固体的作用是。
(5)步骤4中采用减压蒸馏技术,是为了防止
附表相关物质的沸点(101kPa)
| 物质 |
沸点/℃ |
物质 |
沸点/℃ |
| 溴 |
58.8 |
1,2-二氯乙烷 |
83.5 |
| 苯甲醛 |
179 |
间溴苯甲醛 |
229 |
实验室用下图所示装置制备
溶液,并通过
溶液与
溶液的反应制备高效水处理剂
。已知
具有下列性质①可溶于水、微溶于浓
溶液,②在0℃--5℃、强碱性溶液中比较稳定,③在
和
催化作用下发生分解,④在酸性至弱碱性条件下,能与水反应生成
和
。
(1)装置A中
与盐酸反应生成
和
,其离子方程式为。将制备的
通过装置B可除去(填化学式)。
(2)
和KOH在较高温度下反应生成
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是。
(3)制备
时,
饱和溶液与
饱和溶液的混合方式为。
(4)提纯
粗产品[含有
、
等杂质]的实验方案为:将一定量的
粗产品溶于冷的3mol·L-1
溶液中,(实验中须使用的试剂有:饱和
溶液,乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱)。