亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是 ;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的方程式为 ;装置D中反应生成NaClO2的化学方程式为 ;反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是 ;检验该离子的方法是 ;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤.
①减压,55℃蒸发结晶;② ;③ ;④ 得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为 。
为了证明化学反应有一定的限度,进行了如下探究活动:
探究活动一:取5 mL 0.1 mol·L-1的KI溶液于试管,滴加0.1 mol·L-1的FeCl3溶液5~6滴,振荡;
探究活动二:在上述试管中加入2 mL CCl4,充分振荡、静置;
探究活动三:取上述静置分层后的上层水溶液于试管,滴加0.1 mol·L-1的KSCN溶液5~6滴,振荡。
(1)写出探究活动一中反应的离子方程式___________________。
(2)探究活动二的实验现象为________________
A.溶液分层,上层呈紫色
B.溶液分层,下层呈紫色
C.溶液分层,均为无色
(3)在探究活动三中,可以证明该化学反应有一定的限度的实验现象是
已知下表所示数据:
| 物质 |
熔点(℃) |
沸点(℃) |
密度(g·cm-3) |
| 乙醇 |
-117.3 |
78.5 |
0.79 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
| 浓硫酸 |
338.0 |
1.84 |
某学生实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比2∶3∶3配制浓硫酸、乙醇和乙酸的混合溶液。
②按图甲连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管 5~ 10 min。
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。
④分离出乙酸乙酯层,洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为___________________。
(2)导管不能插入到Na2CO3溶液中的原因是____________________________。
(3)步骤②中需要小火均匀加热,其主要原因是________________________________。
(4)指出步骤③所观察到的现象:_______________________________________;
(5)充分振荡试管,然后静置,待液体分层后,分液得到的上层液体即为乙酸乙酯。分离出乙酸乙酯层后,可以用用________________________洗涤.
A.乙醇B.饱和食盐水
C.饱和碳酸钠溶液 D.NaOH溶液
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液。请回答:
(1)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:______________________________
(2)球形干燥管除起冷凝作用外,另一重要作用是_________________。
(3)若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)__________ _;反应结束后D中的现象是________________________。
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示。可能用到的有关数据如下: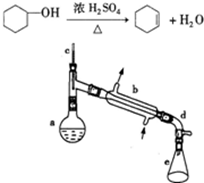
| 相对分子质量 |
密度/(g•cm-3) |
沸点/℃ |
溶解性 |
|
| 环乙醇 |
100 |
0.9618 |
161 |
微溶于水 |
| 环己烯 |
82 |
0.8102 |
83 |
难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:将馏出物倒入分液漏斗中依次用少量5%碳酸钠溶液和蒸馏水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是 _____________。
(2)加入碎瓷片的作用是__________,如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是____________(填正确答案标号)
A.立即补加B.冷却后补加C.不需补加D.重新配料
(3)本实验中最容易产生的有机副产物为 _________________。
(4)在本实验分离过程中,产物应该从分液漏斗的______(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是_________________________。
(6)本实验所得到的环己烯产率是____________。
实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如下:
| 乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g•cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-130 |
9 |
-116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)反应过程中A装置可能产生的酸性干扰气体(填化学式),为此在装置C中应加入_____ (从下列选项中选择)以吸收除杂。
a.水 b.浓硫酸 c.氢氧化钠溶液d.高锰酸钾溶液
(3)装置B是安全瓶,其工作原理是。
(4)若产物中有少量未反应的Br2,最好用下列试剂中的洗涤(填选项符号),再通过的方法分离;
a.水 b.氢氧化钠溶液 c.NaHSO3溶液 d.苯
(5)若产物中有少量副产物乙醚,可用的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是。