高中化学学习阶段,氨的催化氧化反应也可用某金属M(相对原子质量<100)的氧化物做催化剂。M元素的离子在一定条件下能与NH3、卤离子等按某固定比例牢牢结合成稳定的配合物离子(类似于原子团)。
(1)150℃、常压下,6.08g该氧化物与0.6mol HCl气体充分发生复分解反应后,氧化物无剩余,气体变为0.48mol。该金属M的相对原子质量为___________。
将上述反应所得固体溶于水配成50.0mL溶液,该溶液中溶质的物质的量浓度为
_______mol·L-1。
(2)取(1)中所配溶液12.5mL,稀释至25mL,缓缓通入2688mL氨气(标况下),在一定条件下反应恰好完全,得到产物B(摩尔质量为260.5g/mol),继续用1.5mol/L的AgNO3溶液滴定,达到终点时,耗去AgNO3溶液40.0mL。将B投入过量烧碱溶液中,未检测出NH3的逸出。则B的化学式可表示为 。
(3)已知在下图中,L的位置完全相同。现有另一种配离子[M(NH3)6-xClx]n±(1≤x≤5,且x为整数),结构类似下图。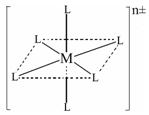
如果该配离子共有2种不同结构,该配离子的式量为 。
(4)一定条件下,3.04g该金属氧化物恰好被某氧化剂(效果相当于0.03mol O2)氧化,再加入0.05mol KCl,经一些特殊工艺处理,K、M两元素恰好完全形成含氧酸盐(式量<360),且盐内部阴阳离子个数比为1:2。则该盐的式量以及物质的量分别为_______________。
CH3OH(g)+H2O(g) CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)在其它条件不变的情况下降低温度,则逆反应速率 (填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率 。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为。
(3)判断该可逆反应达到平衡状态的依据是(填序号) 。
A v正(CH3OH)=v正(CO2)
B 混合气体的密度不变
C 混合气体的平均相对分子质量不变
D CH3OH、H2O、CO2、H2的浓度都不再发生变化
(4)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方向移动的是 (填序号)。
A.升高温度 B.降低温度 C.增大压强
已知A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1∶1,A的相对分子量小于30,在下图变化中,中间产物C跟葡萄糖一样也能跟新制的Cu(OH)2发生反应产生砖红色沉淀,D的水溶液显酸性,E有香味,(反应条件未写出)。
写出下列各步变化的化学方程式并注明反应类型
反应① ; 。
反应② ; 。
反应④ ; 。
反应⑤ ; 。
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如下图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同。回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为,C的元素名称为 。
(3)D的单质与水反应的化学方程式为_。
嫦娥二号运载工具长三丙火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出257KJ的热量。
(1)反应的热化学方程式为 __________________。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点。
(1)下列装置属于原电池的是 ; 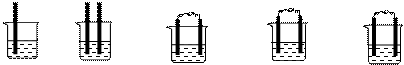
ZnZnCu Zn Cu Cu Cu Fe Cu
稀硫酸稀硫酸酒精稀硫酸稀硫酸
①②③④⑤
(2)在选出的原电池中,______ 是负极,发生______ 反应 ,______ 是正极 ,该极的现象___________________________;
(3)此原电池反应的化学方程式为___________________________。