合成氨和制备硝酸是两种重要的化工生产,四川某化工厂将合成氨与制备硝酸进行连续生产。其工艺流程见右图:
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质 的浓度(mol·L-1)
的浓度(mol·L-1)
如下表:
根据表中数据得知0 min~2 min内N2的平均反应速率是 ,若用CH4与过量水蒸气反应来制氢气,再与氮气合成氨,则理论上CH4与NH3的物质的量之比是 。
(2)今对合成氨反应进行如下研究:
在容积均为10 L的a、b、c三个相同密闭容器
L的a、b、c三个相同密闭容器 中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如右图所示。则下列说法正确的是 。
中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如右图所示。则下列说法正确的是 。
| A.a、b、c三容器5 min时的正反应速率大小为:b>a>c |
| B.达到平衡时,a、b、c三容器中N2转化率为a>b>c |
| C.5 min时,a、b、c三容器中的反应均可能达到平衡状态。 |
| D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压 |
(3)工业上常用尿素作为氮氧化物的吸收剂对尾气进行处理。此法运行费用低,吸收效果好,吸收率高,不产生二次污染。其主要的反应为氮氧化物混合气与水反应生成亚硝酸(HN02),亚硝酸再与尿素[CO(NH2)2]反应生成CO2和N2。 ①HNO2的电子式_________________________
①HNO2的电子式_________________________
②亚硝酸与尿素[CO (NH2)2]反应的化学方程式为_____________________
(4)已知:N2(g)+O2(g)==2NO(g);△H= +180.5kJ/mol
4NH(g)+5O2(g)=4NO(g)+6H2O(g);△H="-905" kJ/mol
2H2(g)+O2(g) =2H2O(g);△H=—483.6 kJ/mol
则在该条件下,氨合成塔中所发生反应的热化学方程式为:
(5)取200 mL的硝酸恰好与32 g Cu2S完全反应,已知硝酸被还原成等物质的量的NO和NO2另外还有CuSO4和Cu(NO3)2生成,则所得工业硝酸的浓度是_ mol·L-1。
( 7分 )某学生设计了如下实验: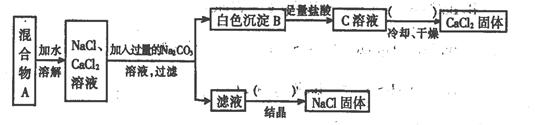
回答下列问题:
(1)该同学的实验目的是
(2)上图括号内的操作步骤均为:,所需的两种玻璃仪器是:、
(3)按此实验方案得到的NaCl固体中肯定含有(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的;
(4)写出生成B的化学方程式:
松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调合香精。
请写出松油醇分别与下列试剂反应所得主要有机产物的结构式(不考虑立体异构体):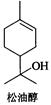
I、Br2/CC14;II、KMnO4(稀、冷溶液);
III、KMnO4/ H3O+;IV、PBr3;
V、(a) Na,(b) CH3I;VI、CH3COC1/碱。
某芳香族化合物A的分子式为C8H9OBr,其苯环上的一氯代物只有两种。A、B、C、D、E、F、G七种物质的转化关系如下图所示(图中某些生成物已略去):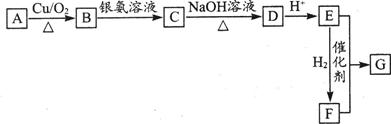
其中A、E与FeCl3溶液均不能发生显色反应,G的相对分子质量为274。
请回答下列问题:
(1)A的结构简式是。
(2)E分子所含含氧官能团的名称是、。
(3)由C生成D的化学方程式是。
(4)由E和F反应生成G的反应类型为,其化学方程式是。
(5) CH3(CH2)5CH=CH(CH2)9CHO是一种昆虫信息素。欲证明该分子中含有碳碳双键的实验方法是。
2005年诺贝尔化学奖授予法国和美国的三位科学家,以表彰他们在烯烃复分解反应研究方面作出的重要贡献。烯烃复分解反应过程被化学家描述为“交换舞伴的交谊舞”。
(I)下列图示可以被理解为烯烃复分解反应过程的是( )。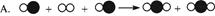

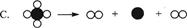

(II)烯烃复分解反应实现了在一定条件下烯烃中碳碳双键两边基团的换位。如:
又已知:两个醛分子在一定条件下可以发生加成反应: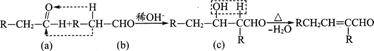
现仅以丙烯为有机原料,经过下列反应可以分别合成重要的化工原料F和K,以F和K为原料可合成一种链状高分子化合物M,其化学组成为(C12H20O4)n。
回答下列问题: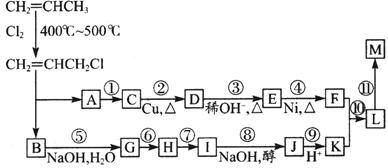
(1)反应①的反应类型是,反应⑤的反应类型是。
(2)反应⑥⑦中有一反应是与HCl加成,该反应是(填反应编号),
设计这一步反应的目的是。
(3) 物质E的结构简式为:,物质M的结构简式为:。
(4)写出下列反应的化学方程式:反应⑧:;
反应⑩:。
.(1)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是。
从废水中回收苯酚的方法是:①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③通入某物质又析出苯酚。试写出②③步的化学反应方程式:
、。
(2)处理含苯酚的工业废水的流程如下: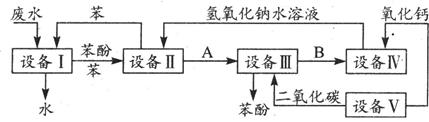
①在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和。
通过(填写操作名称)操作,可以使产物相互分离。
②上面流程中,能循环使用的物质是C6H6、CaO、、。
(3)为测定废水中苯酚的含量,取此废水100mL,向其中滴加溴水至不再产生沉淀为止,得到沉淀0.331g,求此废水中苯酚的含量(mg/L)是。