有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A 2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1) A2B2的电子式为____________。
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1 L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示)。
在b电极上发生的反应可表示为:PbO2+4H++SO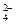 +2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。
+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。
(3)金属元素E是中学化学常见元 素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反
素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反 应的离子方程式为____________________________________。
应的离子方程式为____________________________________。
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为______________________________。比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是___________________________________。
用质量分数为36.5 % 的浓盐酸(密度为1.2 g·cm-3)配制成250 mL 1.2 mol/L的稀盐酸。
(1)经过计算需要_______mL浓盐酸。
(2)在量取浓盐酸后,进行了如下操作:
①等稀释的盐酸冷却到室温后,将溶液沿玻璃棒小心地注入到250 mL的容量瓶中。
②往容量瓶中缓慢地加入蒸馏水至液面接近刻度线1 cm~2 cm处时,改用胶头滴管加蒸馏水,使溶液的凹液面正好与容量瓶的刻度线相切。
③在盛浓盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗液全部注入容量瓶中。
上述操作中,正确的顺序是______________(填编号)。
(3)配制完后,将容量瓶中的稀盐酸转移到指定的试剂瓶中存放,盖好塞子并贴上标签。
已知:A、B、C、D、E、F在常温下均为气体,它们有以下转化关系(部分反应条件、产物已略去)。
请回答下列问题:
(1)将A点燃后伸入到装有E的集气瓶中,可观察到的现象是_________________.
(2)C的浓溶液与黑色粉末反应生成E的化学方程式为________________________。
(3)若将溶液Ⅱ滴入到碘化钾溶液中,发生反应的离子方程式为__________________,向反应后的溶液中加入适量CCl4,充分振荡后静置,可以观察到的现象是_______________。 (4)与溶液Ⅰ比较,溶液Ⅱ中多出的物质是(填化学式)。
(4)与溶液Ⅰ比较,溶液Ⅱ中多出的物质是(填化学式)。
除去下列物质中的杂质,写出发生反应的离子方程式:
(1)硝酸钾中混有溴化钾___________
(2)碳酸氢钾溶液中混有碳酸钾___________,
(3)二氧化碳气体中混有氯化氢气体___________。
氯的原子结构示意图为,卤族元素随着核电荷数的增加,它们的活动性逐渐___________;简单离子的还原性逐渐__________。
由于钠很容易与空气中的、等物质反应,所以钠在自然界里只能以_________态存在。