下图是研究甲烷取代反应实验装置图,具体的实验方法是:
取一个100 mL的大量筒,用排饱和食盐水的方法先后收集20 mL C H4和80 mL Cl2,进行实验。
H4和80 mL Cl2,进行实验。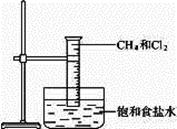
(1)若研究甲烷与氯气的取代反应,还需要的条件是________________________________。
(2)若将如图所示装置放在光亮的地方,等待片刻,观察到的现象是__________________。
(3)若将如图所示装置放在强光下照射会有_________________(填可能发生的不良后果)。
(4)写出甲烷和氯气的第一步反应方程式 。
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L。求2min内A B 反应的平均速率。
(9分) 已知有关物质的氧化性强弱顺序为:浓硫酸>Fe3+>H+>Fe2+。称得 60 g 铁粉与100 mL 浓硫酸在加热的条件下反应,反应最终有固体剩余,共收集到标准状况下气体22.4 L,气体的质量为39.2 g。试回答以下问题:(又知:2Fe 3++ Fe = 3Fe2+)
(1)在加热的条件下开始反应到最终有固体剩余,还涉及到的化学方程式有:
_______________________________________________________________________;
(2)求浓硫酸的物质的量浓度;
(3)反应最终剩余固体的质量。(写出简单的计算过程)
某有机化合物充分燃烧后的产物只有CO2和H2O,摩尔质量为90g/mol,含碳元素的质量分数为40%,氢元素的质量分数为6.67%。
(1)该化合物的分子式为。
(2)取相同质量的该化合物分别与足量的NaHCO3和Na反应,生成标准状况下的气体的量相同,则该有机物可能的结构简式为。
(3)该分子有多种同分异构体,写出满足下列条件的物质与足量乙酸反应的化学方程式::
Ⅰ能与新制的银氨溶液反应生成光亮的银镜;
Ⅱ该物质与足量的乙酸在一定条件下生成1mol有机产物时,质量增加84g。
现有由等质量的NaHCO3和KHCO3组成的混合物a g与100ml盐酸反应。
(题中涉及的气体体积均以标准状况计,填空时可用带字母的式子表示,可不化简)
(1)该混合物中NaHCO3和KHCO3的物质的量之比为
(2)如果碳酸氢盐与盐酸恰好完全反应,则盐酸中的HCl的物质的量为mol
(3)如果盐酸过量,生成CO2的体积是L。
(4) 如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道。
室温时,将20mL某气态烃与过量的氧气混合,充分燃烧后冷却至室温,发现混合气体的体积减少60mL,将所得混合气体通过苛性钠溶液后,体积又减少80mL。
(1)通过计算确定气态烃分子式
(2)若该烃能使溴水和高锰酸钾褪色,且该烃与H2加成后的产物有三个甲基,请写出该烃的结构简式。又知该烃在一定的温度、压强和催化剂的作用下,生成一种高聚物,写出其方程式
已知在T°C和一定压强下,往容积可变的密闭容器中充入2molSO2和1molO2,此时容器容积为VL,保持恒温恒压,使反应:2SO2(g)+O2(g) 2SO3(g)在5min末达到平衡,测得SO3的体积分数为0.4;试回答下列问题:(1)平衡混合气体中SO2的体积分数为,平衡过程中O2的转化率为;(2)另选一容积固定不变的容器,仍控制温度为T°C,充入2molSO2和1molO2使反应,达到平衡时SO3的体积分数仍为0.4,则密闭容器的体积为:L。
2SO3(g)在5min末达到平衡,测得SO3的体积分数为0.4;试回答下列问题:(1)平衡混合气体中SO2的体积分数为,平衡过程中O2的转化率为;(2)另选一容积固定不变的容器,仍控制温度为T°C,充入2molSO2和1molO2使反应,达到平衡时SO3的体积分数仍为0.4,则密闭容器的体积为:L。