在高温时,水蒸气与灼热的炭发生氧化还原反应的化学方程式是H2O+C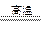 H2+CO,其中水是 剂。硫在氧气中燃烧的化学方程式是 ,其中硫是 剂。
H2+CO,其中水是 剂。硫在氧气中燃烧的化学方程式是 ,其中硫是 剂。
A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈现的化合价依次递增,其中只有B为单质;
②常温下将气体D通入水中发生反应,生成C和E;
③工业上以A、空气和水为原料,通过催化氧化法制取E。
请回答以下问题:
(1)B的电子式为:______,A的结构式为__________,A分子的空间构型是_______;
(2)写出②中涉及反应的化学方程式_____________________________________。
(3)由B反应生成1 molA放出的热量为46.2kJ,写出该反应的热化学方程式,并注明反应条件____________________________________________________________________。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式_______________________________________,生成的大量白烟属于_______化合物。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4= ____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)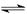 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v (CO2) 表示的反应速率为(取小数点后二位,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K=。
(3) 某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。 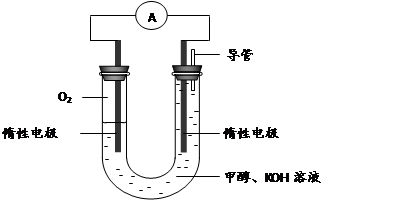
①该电池正极的电极反应为。
② 工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。
⑷CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为。
I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。表1
| 酸或碱 |
电离平衡常数(Ka或 Kb) |
| CH3COOH |
1.8×10-5 |
| HNO2 |
4.6×10-4 |
| HCN |
5×10-10 |
| HClO |
3×10-8 |
| NH3·H2O |
1.8×10-5 |
请回答下列问题:
上述四种酸中,酸性最弱的是(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是(填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
II.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)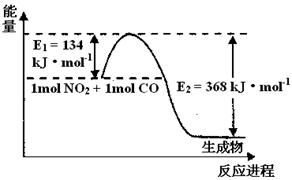
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N2(g)+3H2(g)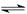 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
①试比较K1.K2的大小,K1_K2(填写“>”.“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是____(填序号字母):
a.容器内N2.H2.NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时, 当测得NH3和N2.H2的物质的量分别为1mol和2mol.3mol时,则该反应的v(N2)正__ v(N2)逆(填写“>”.“=”或“<”)
在一定温度下, 把2molN2和6molH2通入体积不变的容器中。容器中发生以下反应: N2(g) + 3H2(g)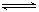 2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:
2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:
保持上述反应温度不变, 设a.b.c分别代表起始加入的N2.H2和NH3的物质的量。如果反应达平衡后混合气体中各物质的百分含量仍与上述平衡时完全相同, 那么:
(1)若a = 1.c =" 2," 则b =。在此情况下, 反应起始时将向方向进行(填“正”或“逆”)。
(2)若需规定起始时反应向逆方向进行,则c的范围是。
已知A为常见金属,X.Y为常见非金属,X.E.F.G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)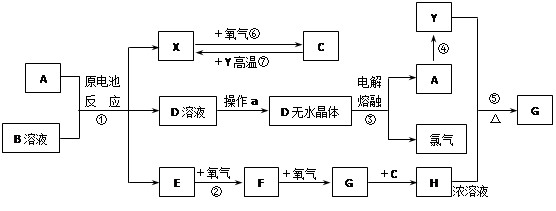
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
(2)从D溶液制备D的无水晶体的“操作a”为。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。