I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。表1
| 酸或碱 |
电离平衡常数(Ka或 Kb) |
| CH3COOH |
1.8×10-5 |
| HNO2 |
4.6×10-4 |
| HCN |
5×10-10 |
| HClO |
3×10-8 |
| NH3·H2O |
1.8×10-5 |
请回答下列问题:
上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是 (填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
II.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)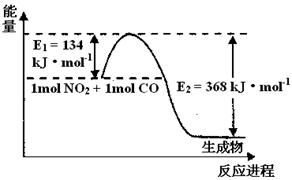
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N2(g)+3H2(g)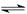 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
①试比较K1.K2的大小,K1_ K2(填写“>”.“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是____(填序号字母):
a.容器内N2.H2.NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时, 当测得NH3和N2.H2的物质的量分别为1mol和2mol.3mol时,则该反应的v(N2)正_ _ v(N2)逆(填写“>”.“=”或“<”)
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。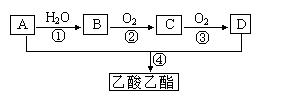
回答下列问题:
(1)写出A的电子式。
(2)B、D分子中的官能团名称分别是、。
(3)写出下列反应的反应类型: ①,④。
(4)写出下列反应的化学方程式:
①;
②;
A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应。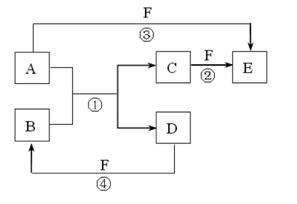
请回答下列问题:
(1)若B是黄绿色气体,C、F是空气的主要成分,A、D相遇有白烟生成,则该白烟的化学式为,反应③的化学方程式为。
(2)若A、D、F都是非金属单质,A、D所含元素同主族,A、F所含元素同周期,则B所属晶体类型是,其一个重要的用途是。
(3)若A是常见的金属单质,D、F是气态单质,反应①②在水溶液中进行,则反应②的离子方程式为。工业上冶炼金属A的反应原理是(用化学方程式表示)。
(4)若A、D是常见单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,反应③④中都有红棕色气体生成。则反应①的化学方程式为
。
在800℃时,在2L密闭容器中将一定量的NO和O2混合发生反应 ,n(NO)随时间的变化如下表:
,n(NO)随时间的变化如下表:
| 时间/s |
0 |
10 |
20 |
30 |
40 |
50 |
| n(NO)/mol |
0.2 |
0.1 |
0.08 |
0.07 |
0.07 |
0.07 |
请回答下列问题:
(1)用O2表示从0~20s内该反应的速率为;达到平衡时NO的转化率为。
(2)若升温到850℃,平衡后n(NO)= n(NO2),则该反应是热反应(填:“吸”、“放”)
(3)下列能说明该反应已达到平衡的是。
A.容器内压强不变 B.容器内气体密度不变
C.n(NO)= n(NO2) D.容器内气体颜色不变
E.容器内混合气体的平均分子量不变 F.v(NO2) =2v(O2)
(4)若改变某一条件,达新平衡时n(NO)=" 0.06" mol,下列说法正确的是。
A.平衡一定正向移动
B.可能是向容器中加入了一定量的NO气体
C.NO的转化率一定增大
D.可能是缩小了容器的体积
(5)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,写出在此条件下该反应的热化学方程式。
X、Y、Z、M、N、K是由短周期元素构成的微粒,其中X、Y、Z是阳离子,M、N是中性分子,K是阴离子,它们具有下列结构特点和性质:
①它们核外电子总数都相同;②N溶于M中,滴入酚酞,溶液变红;
③X和N都由A、C两元素组成,X和Y核内质子数相等;
④Y和K都由A、B两元素组成,Y核内质子总数比K多两个;
⑤Z为单核离子,且离子半径是与其具有相同电子层结构离子中半径最小的。
根据以上信息,请回答下列问题:
(1)Y的化学式为,X的电子式为。
(2)试比较M和N的稳定性:MN(填“>”、“<”、“=”)
(3)检验X的方法是。
(4)由A、B、C三种元素组成的物质中,属于离子化合物的有,属于共价化合物的有(各任写一种物质的化学式)
(5)上述六种微粒中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入0.1mol/L氢氧化钠溶液,随着氢氧化钠溶液的加入,产生沉淀的关系如下图,则该复盐的化学式为。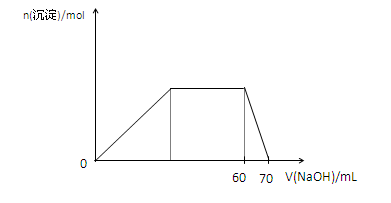
某元素M所形成的气态单质为双原子分子,共有三种形式,其式量分别为70、72、74,它们的物质的量之比为9∶6∶1,则:
(1) M有______种同位素,其质量数分别为_________________;
(2)各种同位素所占的原子百分比分别为多少?
(3)M2的平均式量为多少?