据报道,一种名为苹果醋(ACV)的浓缩饮料 风靡美国。苹果醋是由苹果发酵而成的酸性饮品,具有解毒、降脂、减肥和止泻等功效。苹果酸是这种饮料中的主要酸性物质。已知:在下列有关苹果酸(A)的转化关系中,B能使溴的四氯化碳溶液褪色。
风靡美国。苹果醋是由苹果发酵而成的酸性饮品,具有解毒、降脂、减肥和止泻等功效。苹果酸是这种饮料中的主要酸性物质。已知:在下列有关苹果酸(A)的转化关系中,B能使溴的四氯化碳溶液褪色。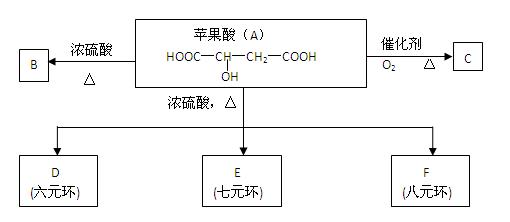
回答下列问题:
(1)苹果酸分子中所含官能团的名称是 。
(2)苹果酸不能发生反应的有 (选填序号);
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应 ⑤消去反应 ⑥取代反应
(3)写出B、C的结构简式:
B: ;
C: 。☆
(4)写出A→D的化学方程式:
。
(5)苹果酸(A)有多种同分异构体,写出所有符合下列条件的同分异构体的结构简式:
①能发生银镜反应; ②能与苯甲酸发生酯化反应; ③能与乙醇发生酯化反应;
④1mol该同分异构体可与足量的钠反应放出1.5mol氢气(分子中同一碳原子不能连有2个羟基)
。
(1)向NaHSO4溶液中逐渐加入Ba(OH)2溶液至中性,写出反应的离子方程式:______________________________________________。
(2)在以上中性溶液中,继续加入Ba(OH)2溶液至沉淀完全,此步的离子方程式为: ____________________________________________。
按要求书写下列离子方程式或化学方程式:
①写出Ba(NO3)2溶液中加稀H2SO4的离子方程式:。
②写出将铁屑加入CuSO4溶液中的离子方程式:。
③将Cu2++2OH-=Cu(OH)2↓改写成化学反应方程式:。
④将CO32-+2H+=CO2↑+H2O改写成一个化学反应方程式:。
写出与下列每一个离子方程式对应的一个化学反应方程式:
(1)CO32-+2H+=H2O+CO2↑:。
(2)H++OH-=H2O:。
(3)Mg+2H+=Mg2++H2↑:。
(4)BaCO3+2H+=Ba2++H2O+CO2↑:。
有下列离子:K+、Mg2+、Ba2+、Na+、SO2-4、OH-、NO-3、Cl-等。按其在溶液中可大量共存的原则,将上述离子等分成两组(要求每组不少于两种阳离子和两种阴离子),则两组分别是______________________________,__________________________。
往平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O ]与氯化铵[NH4Cl]晶体,塞紧瓶塞。在木板上滴少量水,如下图所示。一会儿,就发现瓶内固态物质变成液体,瓶塞变冷,小木板上因少量水冻结而把烧瓶粘住,这时打开瓶塞,放出的气体有氨气的气味。这是自发的发生了吸热反应:。这个现象说明下列结论正确的是
| A.自发反应一定是吸热反应 | B.自发反应一定是放热反应 |
| C.有的吸热反应也能自发进行 | D.吸热反应不能自发进行 |
