如图所示,实验室用NH4Cl和Ca(OH)2制取NH3。试回答下列问题:
(1)写出反应的化学方程式
(2)B处的药品是
(3)检验D处试管中NH3是否收集满,除用湿红色石蕊试纸外,还可用方法是
(4)在标准状况下,收集到224mlNH3后,将它溶于水中,恰好得到100ml氨水,则最后所得溶液的物质的量浓度为 mol/L
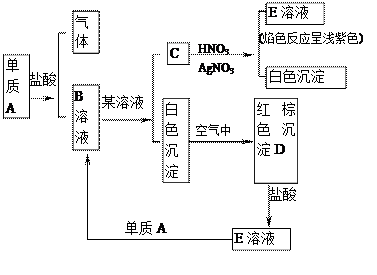
根据图指出A、B、C、D、E各是什么物质?
有机物A的化学式为C6H8O4Cl2,与有机物B、C、D、E的变化关系如下图:
1molA经水解生成2molB和1molC,根据上述变化关系填空:
(1)写出物质的结构简式:A 、 B 、 C 、D 、 E 。
(2)写出E转变为B的化学方程式: 。
一种用于治疗高血脂的新药灭脂灵是按如下路线合成的:已知:
已知G的分子式为C10H22O3,试回答:
(1)写出结构简式:B_________,G _______;
(2)上述反应中属于取代反应的是___________(填序号);
(3)写出反应方程式:
I、反应②___________________________________________________;
Ⅱ、反应⑤___________________________________________________
Ⅲ、F与银氨溶液反应: _______________________________________________
已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 |
a |
I |
e |
| 原子核数 |
单核 |
四核 |
双核 |
| 粒子的电荷数 |
一个单位正电荷 |
0 |
一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
请填写下列空白:
(1)写出下列物质的化学式:B,J。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M
。
②I溶于G
。
(3)在通常状况下,若1 g C气体在B气体
中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为。
下图中A~J分别代表相关反应中的一种物质,已知A分解得到相等物质的量的B、C、D,图中有部分生成物未写出。
请填写以下空白:
⑴B的电子式______________,D分子的空间构型_________________。
⑵写出反应①、②的化学反应方程式:
①_____________________________________________________________;
②_____________________________________________________________。
⑶写出反应③的离子方程式:____________________________________________。