反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2 2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定。
2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定。
| c(H2)/(mol·L-1) |
c(Cl2)/(mol·L-1) |
v/(mol·L-1 ·s-1) ·s-1) |
| 1.0 |
1.0 |
1.0 k |
| 2.0 |
1.0 |
2.0 k |
| 2.0 |
4.0 |
4.0 k |
由此可推得,m、n值正确的是:
| A.m=1,n=1 | B.m=1/2,n=1/2 | C.m=1/2,n=1 | D.m=1,n=1/2 |
A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C-,A2-离子半径大于C-,B2+与C-具有相同的电子层结构。下列叙述中不正确的是
A.原子序数A>B>C B.离子半径A2->C->B2+
C.原子半径C>B>A D.最外层电子数C>A>B
用下列实验装置进行相应实验,能达到实验目的的是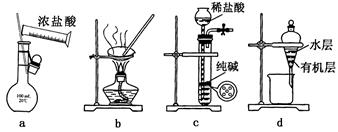
| A.用图a所示装置配制100mL0.100mol·L-1稀盐酸 |
| B.用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体 |
| C.用图c所示装置制取少量纯净的CO2气体 |
| D.用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
下列有关化学实验叙述正确的是
| A.容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水 |
| B.用98%的浓硫酸配制100g10%的稀硫酸时,除使用量筒外还需用到容量瓶 |
| C.存放浓硝酸时,使用带橡胶塞的棕色玻璃瓶 |
| D.取用化学药品做实验,剩余药品都倒入同一废液缸中 |
下列有关做法正确的是
| A.将水沿烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌 |
| B.实验室制取氯气时,尾气用碱液吸收 |
| C.金属钠、镁着火时,可用泡沫灭火器来灭火 |
| D.夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏的原因,然后打开所有的门窗通风 |
下列叙述不正确的是
| A.通过单质Fe与Cl2、S反应的产物可以判断Cl2和S的氧化性强弱 |
| B.向饱和Ca(OH)2溶液中加入一小块钠,溶液中有固体析出 |
| C.浓硫酸在常温下能够使铁、铝等金属钝化 |
| D.干燥的氯气可使湿润的pH试纸退色,说明Cl2具有漂白性 |