 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题: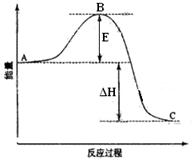
(1)  图中E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”
图中E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变” )。
)。 (2)图中△H= KJ·mol-1。
(2)图中△H= KJ·mol-1。
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
(1)A点的沉淀物的化学式为。
(2)写出A点至B点发生反应的离子方程式:。
(3)原混合物中NaOH的质量是g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为mL。
实验室可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①请用“双线桥”标出电子转移的方向和数目;
②该反应中被氧化和未被氧化的HCl的物质的量之比是 _______。
将0.1 mol的MnO2和40 mL 10 mol·L-1的浓盐酸混合后加热,充分反应后,向所得溶液中加入足量的AgNO3溶液。在此过程中:
(1)产生的Cl2在标准状况下的体积V(Cl2)为______(填写体积范围);
(2)产生的AgCl沉淀的物质的量为______ (假设盐酸不挥发,且产生的Cl2的物质的量为a mol)。
A、B、C、D、E是短周期的五种主族元素。A元素的某种原子,其核内没有中子;B元素的基态原子2p轨道上只有一对成对电子;C与B处于同一周期,且原子半径小于B;D与C是同主族元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)B元素的原子结构示意图是 ;C元素原子的电子排布图是 ;D元素原子的价电子排布式是 ;
(2)A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是(用化学式表示) ;(3)由B、D、E三种元素组成的某种化合物的水溶液能使pH试纸先变蓝后褪色,写出该化合物的化学式 ;用一个离子方程式表明该化合物水溶液使pH试纸先变蓝后褪色的原因 。
根据下列五种元素的第一至第四电离能数据(单位: kJ·mol-1),回答下列各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2 080 |
4 000 |
6 100 |
9 400 |
| R |
496 |
4 562 |
6 912 |
9 543 |
| S |
738 |
1 451 |
7 733 |
10 540 |
| T |
578 |
1 817 |
2 745 |
11 575 |
| U |
420 |
3 100 |
4 400 |
5 900 |
(1)在周期表中,最可能处于同一族的是________。
A.Q和R B.S和TC.T和UD.R和T E.R和U
(2)下列离子的氧化性最弱的是________。
A.S2+B.R2+C.T3+D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是____。
A.硼B.铍 C.氦 D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明:______,如果U元素是短周期元素,你估计它的第2次电离能飞跃数据将发生在失去第_____个电子时。
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________,其中元素________的第一电离能异常高的原因是__________________。