A、B、C、D、E是短周期的五种主族元素。A元素的某种原子,其核内没有中子;B元素的基态原子2p轨道上只有一对成对电子;C与B处于同一周期,且原子半径小于B;D与C是同主族元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)B元素的原子结构示意图是 ;C元素原子的电子排布图是 ;D元素原子的价电子排布式是 ;
(2)A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是(用化学式表示) ;(3)由B、D、E三种元素组成的某种化合物的水溶液能使pH试纸先变蓝后褪色,写出该化合物的化学式 ;用一个离子方程式表明该化合物水溶液使pH试纸先变蓝后褪色的原因 。
下图是元素周期表的一部分,针对表中的①—⑧八种元素,用元素符号或化学式回答相关问题:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为___________。
(2)地壳中含量最多的金属元素是___________。
(3)用电子式表示①与③形成化合物的过程:__________________________。
(4)这些元素的氧化物对应的水化物中,酸性最强的是________,碱性最强的是__________,显两性的是___________,该两性物质与②的最高价氧化物对应水化物的溶液反应的离子方程式为:
_______________________________。
(5)①②③④四种元素的简单离子核外电子排布相同,都有__________个电子,它们的离子半径由大到小的顺序是__________________(用“>”表示)。
(6)①⑤⑧三种元素的单质沸点由高到低的顺序是__________________(用“>”表示)。
将影响反应速率条件的编号填在空格处。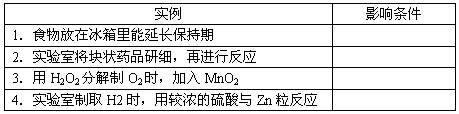
| A.温度 | B.催化剂 | C.固体的表面积 | D.溶液的浓度 |
下列几组物质:
| A.金属石和石墨 | B.C2H6和C5H12 | C.C2H4和C2H6 |
| D.CH3CH2CH2CH3 E.35Cl和37Cl |
(1)属于同分异构体的是___________(填序号,下同);(2)属于同素异形体的是____________;
(3)属于同素物的是___________;(4)属于同位素的是________________。
在NaCl、NH4Cl、N2、CO2中,只含有离子键的是________(填化学式,下同),只含有极性键的是_________,只含有非极性键的是__________,既含有离子键又含有共价键的是__________。
在①6Li ②14N ③7Li ④14C几种核素中:
(1)________和________(填序号,下同)互为同位素。
(2)________和________的质量数相等,但不能互称同位素。