(1)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式 。
(2)利用该反应设计一个燃料电池:用KOH溶液作电解质溶液,多孔石墨作电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为 极(填“正”或“负”),该电极上发生的电极反应式为 。
(3)在右图所示实验装置中,石墨棒上的电极反应式为 。如果起始时盛有1L pH=5的CuSO4溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 。若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。

(4)将普通碳钢钉放入“84消毒液”(NaClO溶液)中浸泡一段时间。预期的实验现象是 。
(5)为了进一步探究碳钢钉在该消毒液(NaClO)中的腐蚀原理,某同学设计了如图所示实验装置,写出碳(C)极上发生的电极反应式 。

(1)、①用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+10.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-543kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,其很容易转化为二氧化氮。试推断由二氧化氮制取四氧化二氮的反应条件(或措施):。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。
图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e →2O2-)
①c电极为,d电极上的电极反应式为。
②图乙是电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式为。若a电极产生56mL(标准状况)气体,则所得溶液的pH=(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入(选填字母序号)
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
(1)请完成该反应的离子方程式:
C +MnO4- +H+ — CO2↑+Mn2+ +H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应CO(g ) + H2O(g)  CO2(g) + H2(g)得到如下两组数据:
CO2(g) + H2(g)得到如下两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为 。(精确到0.01)
②该反应为(填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为。
(3)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa |
2×105 |
5×105 |
1×106 |
| c(A)/mol·L-1 |
0.08 |
0.20 |
0.44 |
①当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
②当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K=。⑷在25℃下,向浓度为0.1mol·L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为mol/L 。(已知25℃时Ksp[Fe(OH)3]=4×10-38)
氧化锌粉末广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃等行业,为综合应用资源,常从冶炼锌、锌制品加工企业回收的锌渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如图: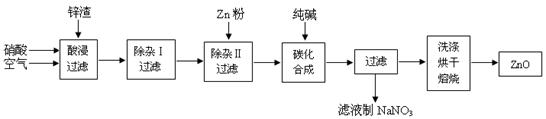
有关氢氧化物沉淀完全的pH见下表: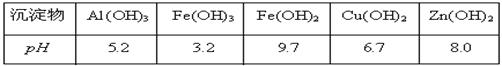
(1)在酸浸过程中,常将锌渣碎成粉末并通入空气,同时保持酸过量,理由是。
(2)上述工艺多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、。
(3)①在“除杂Ⅰ”中,常用酸性KMnO4溶液,其目的是,KMnO4是该反应的(氧化剂、还原剂)。将溶液的pH调至4,目的是。
②在“除杂II”中,加入锌粉的目的是。
(4)在“碳化合成”中,产物中有碱式碳酸锌[Zn2(OH)2CO3]和CO2等,请写出该反应的化学方程式。
(5)本工艺中,过滤分离次数较多,其明显的缺陷是。
为实现 “节能减排” 和“低碳经济”的一项课题是如何将CO2转化为可利用资源。
(1)25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出热量363.3kJ,该反应的热化学方程式为。
(2)目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH=-49.0 kJ/mol。
CH3OH(g)+H2O(g)ΔH=-49.0 kJ/mol。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①该反应的平衡常数表达式K=;
②从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=(注明单位);H2的转化率=;
③下列说法中,能说明上述反应达到平衡状态的是
A.每消耗1mol CO2的同时生成1mol CH3OH
B.CO2、H2、CH3OH和H2O的物质的量的比为1∶3∶1∶1
C.容器中气体的压强不再改变
D.容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是
A.升高温度B.将CH3OH(g)从体系中分离
C.使用高效催化剂D.恒温恒容再充入1 molCO2和3 mol H2
邻羟基桂皮酸(IV)是合成香精的重要原料,下列为合成邻羟基桂皮酸(IV)的路线之一。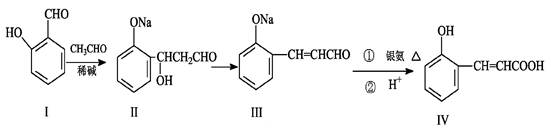
试回答:
(1)I中含氧官能团的名称和。
(2)II→III的反应类型。
(3)①IV与乙醇和浓硫酸混合加热的化学方程式。
②IV与过量NaOH溶液反应的化学方程式。
(4)有机物X与IV互为同分异构体,且X有如下特点:
①是苯的对位取代物, ②能与NaHCO3反应放出气体 ,③能发生银镜反应。
请写出X的一种结构简式。
(5)下列说法正确的是
| A.I的化学式为C7H8O2 | B.I遇氯化铁溶液呈紫色 |
| C.II能与NaHCO3溶液反应 | D.1mol有机物IV最多能与4mol H2加成 |