A、B、C、D 为4种金属。将A、B分别加入等浓度稀盐酸中,B比A反应更剧烈。将A、D用导线连结,同时浸入稀硫酸中,D表面出现大量气泡。将D浸入C的盐溶液中,有C析出。则其金属活动性由强到弱的顺序是
A.B>A>D>C B.A>B>D>C C.B>A>C>D D.C>D>A>B
下列装置或操作能达到相应实验目的的是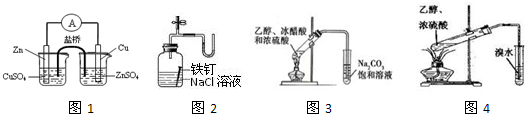
| A.图1构成锌—铜原电池 | B.图2证明铁生锈与空气有关 |
| C.图3制备乙酸乙酯 | D.图4证明乙醇发生消去反应生成了乙烯 |
已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水。下列说法不正确的是
A.简单离子的半径:C>D>E>B B.工业上常用电解法制得C和D的单质
C.稳定性:A2B>A2E D.单质D可用于冶炼某些难熔金属
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是
| 选项 化合物 |
A |
B |
C |
D |
| Y |
CO2 |
Fe2O3 |
C2H5OH |
FeCl3 |
| W |
MgO |
Al2O3 |
C2H5ONa |
CuCl2 |
下列说法正确的是
| A.将氯化镁溶液直接蒸发至干,可获得纯净的无水MgCl2固体 |
| B.二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C.用KSCN溶液检验硫酸亚铁溶液是否氧化变质 |
| D.用苯萃取溴的四氯化碳溶液中的溴 |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.无色透明的溶液中:MnO4-、SO42-、K+、Fe2+ |
| B.pH=1的溶液中:NH4+、Na+、SO42-、Fe3+ |
| C.含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3- |
| D.水电离产生的c(H+)=1×10-14mol·L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |