实验室需配制4%的氢氧化钠溶液200g,并用此溶液测定某敞口放置一段时间的盐酸的溶质质量分数。
(1)配制200g质量分数为4%的氢氧化钠溶液,需要氢氧化钠固体的质量为 g,水的体积为 mL(水的密度近似看作1g/cm3)。 (2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
(2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
4%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)
测定溶液的pH,得到的数据如下:
| 加入氢氧化钠 的体积/mL |
0 |
1.0 |
8.0 |
9.5 |
10.5 |
12.0 |
16.5 |
| 烧杯中溶液pH |
1.0 |
1.3 |
2.0 |
3.9 |
9.9 |
11.9 |
12.8 |
依据表中数据绘制出烧杯中溶液的pH与加入氢氧
化钠溶液体积(V)之间的变化关系图。
(3)根据上图查出氢氧化钠与盐酸恰好完全反应时,所滴加氢氧化钠溶液的体积为 mL,A点所表示的溶液中溶质的化学式为 。
(4)计算此瓶盐酸的溶质质量分数。(请写出计算过程。氢氧化钠溶液的密度按1.0g/mL计算)
将适量的小苏打(NaHCO3)与待发酵的面粉混合揉匀,制作出的馒头或面包里有许多小孔,吃起来松软可口。小明同学对小苏打样品进行研究:①观察样品为白色粉末;②取少量样品放入适量水中,样品完全溶解;③用pH试纸测其溶液的酸碱度,pH=11;④取少量样品加入稀盐酸,产生大量气泡;⑤取少量样品放入试管中加热,试管内壁上有水珠。
请你根据小明同学的研究回答下列问题。
(1)小苏打表现出的物理性质是_____________;小苏打溶液的pH=11,说明其溶液呈_________性;第⑤项研究中发生的化学反应,其类型属于__________反应。
(2)馒头或面包里形成许多小孔的重要原因是在制作过程中有__________生成。生成这种物质的主要原因是____________;写出小苏打与盐酸反应的化学方程式___________________________________。
(3)写出你所知道的小苏打的一种其他用途:_______________________。
化学就在我们身边,它与我们的生活息息相关。从石灰石、碳酸氢钠、稀盐酸、食盐四种物质中选出与下列用途相对应的物质,填写在空白处:
(1)可用于焙制糕点时的发酵粉________________________;
(2)烹饪时做调味品的是______________________________;
(3)可用作建筑材料的是______________________________;
(4)常用于除去金属铁表面的铁锈的是__________________。
用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示。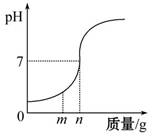
熟石灰与盐酸反应的化学方程式为____________;当加入熟石灰m g时,溶液中的溶质为_______。若改用n g氢氧化钠与相同量盐酸反应,所得溶液的pH_______7(填“>”“<”或“=”)。
小红同学自制成一种黄色的花汁,加入到不同试剂中,观察到的现象如下:
| 试剂 |
稀盐酸 |
食盐水 |
蒸馏水 |
草木灰水 |
石灰水 |
| 颜色 |
红 |
黄 |
黄 |
绿 |
绿 |
小红依据上表信息进行如下实验:
(1)用该花汁去检验附近小化工厂排放的废水的酸碱性,显浅红色,则此废水显____________性。
(2)用该花汁测知家中花盆土壤显酸性,要改良该土壤可加入上表中的______。
(3)取5 mL显红色的稀盐酸,然后逐滴滴加显绿色的石灰水至恰好反应,所得溶液颜色应该是________________。
硫酸和盐酸既是实验室常用的试剂,也是重要的化工原料。它们既有相似之处,又有不同之点。
(1)它们水溶液的pH都__________7(填“大于”“小于”或“等于”)。
(2)它们都能除铁锈,写出盐酸与铁锈主要成分反应的化学方程式__________
__________________。
(3)它们都能与碱反应生成盐和水,该类反应叫_________反应。
(4)打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是_________。