已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6。M与其他物质的转化关系如下(部分产物已略去):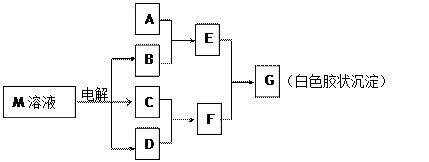
(1)若A是与X、Y同周期的一种常见金属,则A元素在周期表中的位置是 周期
族,写出A与B溶液反应的化学方程式 。
(2)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示
意图为 ,写出E与F反应的离子方程式 。
(3)B的电子式为__________,其中的化学键为______________。
用电子式表示M的形成过程 。
(4)工业上用电解物质M的产物之一氧化有毒含氰(CN—)碱性废水,得到无毒的N2、CO2等。写出此反应的离子反应方程式 。
下图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH === 2K2CO3+6H2O
请回答:
(1)甲池是__________(填“原电池”或“电解池”),通入CH3OH的电极作为_____极,通入O2的电极作为_____极,该电极反应式为_________________________________。
(2)乙池是__________(填“原电池”或“电解池”),A电极名称为_____极,电极反应式为_________________________________。
(3)甲池中溶液的pH_____ (填“增大”、“减小”或“不变”);乙池中溶液的pH_____(填“增大”、“减小”或“不变”)。
(4)当乙池中B(Ag)极的质量增加5.40 g时,电路中转移电子的物质的量是_____mol,甲池中理论上消耗O2_____mL(标准状况下)。
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。在催化剂作用下,CO可用于合成甲醇:CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
(1)若在恒温恒压的条件下,向密闭容器中充入4 mol CO和8 mol H2,合成甲醇,平衡时CO的转化率与温度、压强的关系如图所示:
①该反应的正反应属于________反应(填“吸热”或“放热”)。
②在0.1 MPa、100 ℃的条件下,该反应达到平衡时容器内气体的物质的量为_________mol。
(2)若在恒温恒容的条件下,向上述平衡体系中充入4 mol CO,8 mol H2,与(1)相比,达到平衡时CO转化率_______(填“增大”,“不变”或“减小”), 平衡常数K_______(填“增大”,“不变”或“减小”)。
(3)在上述合成甲醇的反应中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:①CH4(g) + H2O(g) = CO(g) + 3H2(g)ΔH =" +206.2" kJ·mol-1
②CH4(g) + CO2(g) =" 2CO(g)" + 2H2(g) ΔH =" +247.4" kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:。
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10)。
(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为________________。
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为_________________。
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
①NaOH标准溶液应盛放在下图所示的滴定管____(选填“甲”或“乙”) 中。
②滴定时所用的指示剂X可为________,判断滴定终点的方法是_________________________。
③下列操作会导致测定结果偏低的是________________
| A.碱式滴定管未润洗 |
| B.锥形瓶用待测液润洗 |
| C.读取标准液读数时,滴定前仰视,滴定到终点后俯视 |
| D.滴定前碱式滴定管尖嘴处有气泡未排除,滴定后气泡消失 |
④滴定实验记录如下表(样品中杂质不与酸或碱反应)。
| 滴定次数 |
待测溶液A的体积(mL) |
消耗0.1000mol·L-1NaOH溶液的体积 |
| 1 |
25.00 |
22.50 |
| 2 |
25.00 |
22.55 |
| 3 |
25.00 |
22.45 |
试计算样品中Na5P3O10的物质的量为__________mol。
现有浓度均为0.1 mol·L-1的下列溶液:①盐酸②醋酸③氢氧化钠④氯化铵⑤硫酸氢铵⑥氨水,请回答下列问题:
(1)已知t ℃时,Kw=1×10-13,则t ℃(填“>”“<”或“=”)____________25 ℃。
(2)②③④三种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)_________。
(3)④⑤⑥四种溶液中NH4+浓度由大到小的顺序是(填序号)__________________。
(4)常温下,将①和③按体积比2:1混合后,溶液的pH约为_______(已知lg3 = 0.5)。
(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏(CaSO4·2H2O)可以降低土壤的碱性。试用化学方程式表示用石膏降低土壤碱性的反应原理________。
(2)习惯上把电解饱和食盐水的工业生产叫做氯碱工业,用化学方程式表示电解饱和食盐水的总反应为________________________。
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是_____________。(填写化学式,只填一种即可)
(4)通过火法冶金炼出的铜是粗铜,不适于电器及其他许多工业使用,必须进行电解精炼。电解时,用________作阴极,________作阳极。