碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用。
(1)真空碳热还原一氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g);△H= a kJ•mol-1
3AlCl(g)= 2Al(l)+ AlCl3(g);△H= b kJ•mol-1
反应Al2O3(s)+ 3C(s)= 2Al(l)+ 3CO(g)的△H= kJ•mol-1
(用含a、b的代数式表示)。
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g) N2(g)+ CO2(g);△H= Q kJ•mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+ CO2(g);△H= Q kJ•mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol/L) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K=
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容绝热条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)
a.单位时间内生成2nmol NO(g)的同时消耗nmol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
(共10分)A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大。A是宇宙中含量最高的元素,B可形成多种同素异形体,其中一种的硬度自然界中最大。D元素原子的最外层电子数是次外层电子数的3倍。E元素的最高价氧化物的水化物的酸性强于硫酸。
(1)写出元素C在元素周期表的位置 ,单质E的工业制备的离子方程式为________。
(2)B、C、D三种元素的最简单氢化物的稳定性从大到小的顺序是 (填化学式),
B的单质在加热条件下能与C的最高价氧化物对应的水化物的浓溶液反应,写出对应的化学方程式 。
(3)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒中离子之间反应的一个离子方程式: 。
NO分子曾因污染空气而臭名昭著,但随着其“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题
(1)NO的危害在于
a.破坏臭氧层b.参与酸雨和光化学烟雾的形成
c.与人体内血红蛋白结合d.当它转化为N2后使空气中O2含量降低
(2)在含有Cu+的酶的活化中心,亚硝酸根离子(NO2-)可转化为NO,写出Cu+和NO2-在酸性溶液中转化为NO的离子方程式 _________ 。
(3)一定条件下NO可转化为N2O和另一种红棕色气体,方程式为 。
(4)将0.05molNO、0.03molO2的混合气体以适当的速率缓慢通入盛有100mL水的集气瓶中,最终所得溶液中溶质的物质的量浓度为(设溶液体积变化忽视不计) _________。
(5)镁铁混合物4.9g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2.24L NO 气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是__________________。
向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀的物质的量(n)和加入溶液B的体积(V)关系如图。
(1)当加入B溶液110mL时,溶液中的沉淀为(化学式)_____ ___ __
(2)从90 mL至100 mL之间加入10 mL B溶液时发生的离子反应方程式
(3)将A、B溶液中各溶质的物质的量浓度填入下表
| 溶质 |
Na2SO4 |
NaOH |
BaCl2 |
AlCl3 |
FeCl3 |
| C(mol/L) |
常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:
①M的焰色反应呈黄色。
②五种盐均溶于水,水溶液均为无色。
③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,所含阴离子相同的两种盐的化学式是__________________
(2)M溶液显碱性的原因是(用离子方程式表示)___________ __________
(3)X和Z的溶液反应的离子方程式是____________________
(4)N和氨水反应的离子方程式是__________________
(5)若要检验Y中所含的阳离子,正确的实验方法是_________________
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系: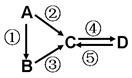
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式