随着铅蓄电池的广泛应用,使回收利用铅资源成为重要课题。某研究性学习小组利用废旧铅蓄电池阴、阳极填充物(铅膏)制备塑料加工热稳定剂三盐基硫酸铅,实验流程如下: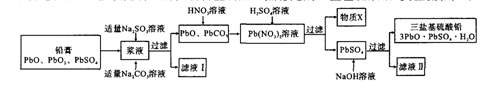
(1)物质X是一种可循环利用的物质,该物质是 。
(2)生成三盐基硫酸铅的反应的离子方程式为 。
(3)将滤液I和滤液Ⅱ合并后可用来提取一种钠盐副产品(相对分子质量为322),已知副产品带10个结晶水的结晶水合物,则其化学式 ,由滤液提取该副产品的主要实验步骤依次为 、 、过滤、洗涤、干燥。
(4)过滤时洗涤沉淀(或固体)的操作方法是 。
。
(5)向铅膏浆液中加入Na2SO3溶液的目的是将PbO2还原为PbO,若实验中所取铅膏浆液质量为47.8g,其中PbO2的质量分数为15.0%,要将PbO2还原,至少需要加入
mL1.0mol·L-1Na2SO3溶液。
A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
(1)写出A、B、C三元素的名称:A是__________,B是__________,C是__________。
(2)B、C两元素可形成BC6型化合物,该化合物(填“能”或“不能”)燃烧,其理由是______________________________________________________________________________。
设X、Y、Z代表3种元素。已知:
①X+和Y-两种离子具有相同的电子层结构
②Z元素原子核内质子数比Y元素原子核内质子数少9个
③Y和Z两元素可以形成4核42个电子的负一价阴离子
据此,请填空:
(1)Y元素是_________,Z元素是_________。
(2)由X、Y、Z三元素所形成的含68个电子的盐类化合物的分子式(即化学式)是___________。
A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。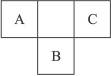
(1)写出A、B、C三元素的名称:A是__________,B是__________,C是__________。
(2)B、C两元素可形成BC6型化合物,该化合物(填“能”或“不能”)燃烧,其理由是______________________________________________________________________________。
A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;C是F不同周期的邻族元素;B原子最外层电子数是次外层的两倍;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;E和F的原子序数之和为30。由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物如下图所示:
请完成下列问题:
(1)化合物己的电子式:________________。
(2)向含有1 mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为______mol。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为____________。
(4)F的单质与甲反应的离子方程式为_______________。
(5)将丁与二氧化碳反应生成的盐置于戊的水溶液中,发生反应的离子方程式为___________。
下表是元素周期表的一部分,完成下列有关问题:

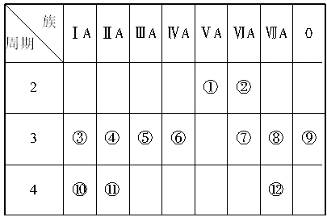
(1)写出下列元素符号:①__________,⑥__________,⑦__________,⑪__________。
(2)在这些元素中,最活泼的金属元素是_____,最活泼的非金属元素是_____,最不活泼的元素是_____。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是_____,碱性最强的是_____,呈两性的氢氧化物是_____,写出三者之间相互反应的化学方程式:_______________
(4)在这些元素中,原子半径最小的是_____,原子半径最大的是_____。
(5)在③与④中,化学性质较活泼的是,怎样用化学实验证明?答:__________。在⑧和⑫中,化学性质较活泼的是_____,怎样用化学实验证明?