(10分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)写出与H2O分子互为等电子体的微粒 (填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶 体类型相同的是 (请用相应的编号填写)
体类型相同的是 (请用相应的编号填写)
(5)在冰晶体中,每个水分子与相 邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;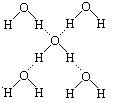
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:  。
。
【2015海南化学】单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题: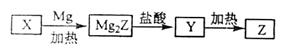
(1)能与X发生化学反应的酸是 ;由X制备Mg2Z的化学方程式为 。
(2)由Mg2Z生成Y的化学反应方程式为 ,Y分子的电子式为 。
(3)Z、X中共价键的类型分别是 。
【2015重庆理综化学】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应)。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为 ,K的原子结构示意图为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。
【2015浙江理综化学】Ⅰ.请回答:
(1)H2O2的电子式___________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由_____________。
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式__________。
(4)完成以下氧化还原反应的离子方程式:
()MnO4-+()C2O42-+______=()Mn2++()CO2↑+________
Ⅱ.化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的H2。
请推测并回答:
(1)甲的化学式__________。
(2)甲与AlCl3反应得到NaAlH4的化学方程式__________。
(3)NaAlH4与水发生氧化还原反应的化学方程式__________。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式 。
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的。
判断该同学设想的制备和验纯方法的合理性并说明理由___________。
【2015新课标Ⅰ卷理综化学】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示: 回答下列问题:
回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式___________。为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有_________(写出两条)。
(2)利用 的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是______(写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是_______。然后再调节溶液的pH约为5,目的是________。
(4)“粗硼酸”中的主要杂质是 (填名称)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_______。
(6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程___________。
【2015江苏化学】以磷石膏(只要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见由下图。清液pH>11时CaSO4转化的离子方程式_____________;能提高其转化速率的措施有____(填序号)
| A.搅拌浆料 | B.加热浆料至100℃ |
| C.增大氨水浓度 | D.减小CO2通入速率 |
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为______和________(填化学式);检验洗涤是否完全的方法是_________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因___________。