有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。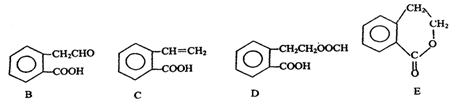
请回答下列问题:
(1)指出反应的类型:A→C: 。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(5)C能形成高聚物,该高聚物的结构简式为 。
(6)写出D与NaOH溶液共热反应的化学方程式
。
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色.
请根据上述信息回答:
(1)H中含氧官能团的名称是________.B→I的反应类型为________.
(2)只用一种试剂鉴别D、E、H,该试剂是________.
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为________________.
(4)D和F反应生成X的化学方程式为________________________________.
A、B、C、D、E均为有机化合物,它们之间的关系如下所示(提示:RCH===CHR′在KMnO4酸性溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基)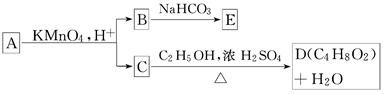
回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为________.
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1∶2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是__________________________,反应类型为________.
(3)A可以与金属钠作用放出氢气,能使溴的CCl4溶液退色,则A的结构简式是____________________.
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有________种,其相应的结构简式为________.
丙酸丙酯是一种香料,可以用下面的方案合成:
(1)写出A、B、C、D的结构简式:
A________、B________、C________、D________.
(2)D有很多同分异构体,其中含有羧基的同分异构体中,烃基上的一氯代物有2种的结构简式为________________________.
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH.
②有关有机物的沸点见下表:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点(℃) |
34.5 |
78.3 |
118 |
77.1 |
某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有乙醇、无水醋酸和浓硫酸,B中放有饱和碳酸钠溶液.试回答: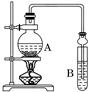
(1)A中浓硫酸的作用是________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:______________________.
(2)B中球形管的两个作用是________、________.若反应前向B中溶液滴加几滴酚酞,呈红色,产生此现象的原因是__________________________(用离子方程式表示);反应结束后B中的现象是______________________________.
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平.请回答下列问题.
(1)乙烯的结构简式______________________.
(2)鉴别甲烷和乙烯的试剂是________(填序号).
| A.稀硫酸 | B.溴水 |
| C.水 | D.高锰酸钾酸性溶液 |
(3)若以乙烯为主要原料合成乙酸,其合成路线如下图所示(其中A与二甲醚是同分异构体)
反应②的化学方程式为_____________________________________________.