丙酸丙酯是一种香料,可以用下面的方案合成:
(1)写出A、B、C、D的结构简式:
A________、B________、C________、D________.
(2)D有很多同分异构体,其中含有羧基的同分异构体中,烃基上的一氯代物有2种的结构简式为________________________.
氯气常用于自来水厂杀菌消毒。
(1)工业上用铁电极和石墨做为电极电解饱和食盐水生产氯气,铁电极作极,石墨电极上的电极反应式为。
(2)氯氧化法是在碱性条件下,用Cl2将废水中的CN-氧化成无毒的N2和CO2。该反应的离子方程式为。
(3)氯胺(NH2Cl)消毒法是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2 + NH3 = NH2Cl + HCl,生成的NH2Cl比HClO稳定,且能部分水解重新生成HClO,起到消毒杀菌的作用。
①氯胺能消毒杀菌的原因是(用化学用语表示)。
②氯胺消毒法处理后的水中,氮元素多以NH4+的形式存在。
已知:NH4+(aq) + 1.5O2(g)= NO2-(aq) + 2H+(aq) + H2O (l)ΔH=-273 kJ·mol-1
NH4+(aq) + 2O2(g)= NO3-(aq) + 2H+(aq) + H2O (l)ΔH =-346 kJ·mol-1
NO2-(aq)被O2氧化成NO3-(aq)的热化学方程式为。
(4)在水产养殖中,可以用Na2S2O3将水中残余的微量Cl2除去,某实验小组利用下图所示装置和药品制备Na2S2O3。

结合上述资料回答:
开始通SO2时,在B口检测到有新的气体生成,判断从B口排出的气体中是否含有H2S,并写出判断依据。
为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因是。
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示:
①加入试剂a后发生反应的离子方程式为。
②操作b为,操作c为。
③Al(NO3)3待测液中,c (Al3+) = mol·L-1(用m、v表示)。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在范围内(填字母序号)。
| 物质 |
Na |
S |
Al2O3 |
| 熔点/℃ |
97.8 |
115 |
2050 |
| 沸点/℃ |
892 |
444.6 |
2980 |
a.100℃以下 b.100℃~300℃ c. 300℃~350℃ d. 350℃~2050℃
②放电时,电极A为极。
③放电时,内电路中Na+的移动方向为(填“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx =" 2Na" + xS(3<x<5),则阳极的电极反应式为。
光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):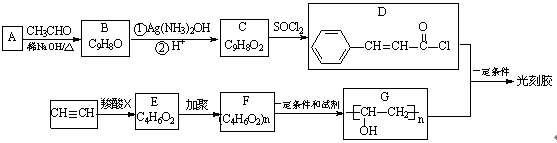
已知:
Ⅰ.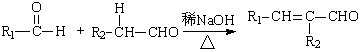 (R,R’为烃基或氢)
(R,R’为烃基或氢)
Ⅱ.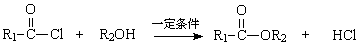 (R,R’为烃基)
(R,R’为烃基)
(1)A分子中含氧官能团名称为 。
(2)羧酸X的电离方程式为 。
(3)C物质可发生的反应类型为 (填字母序号)。
a.加聚反应 b. 酯化反应 c.还原反应 d.缩聚反应
(4)B与Ag(NH3)2OH反应的化学方程式为 。
(5)乙炔和羧酸X加成生成E,E的核磁共振氢谱为三组峰,且峰面积比为3:2:1,E能发生水解反应,则E的结构简式为 。
(6)与C具有相同官能团且含有苯环的同分异构体有4种,其结构简式分别为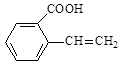 、
、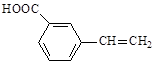 、 和 。
、 和 。
(7)D和G反应生成光刻胶的化学方程式为 。
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下: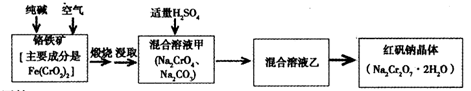
请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是____价。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成____。
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下: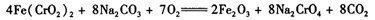
为了加快该反应的反应速率,可采取的措施是____。
(4)已知CrO42—在不同的酸性溶液中有不同的反应,如:
①往混合溶液甲中加入硫酸必须适量的原因是____。
②混合溶液乙中溶质的化学式是____。
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72—必须除去。工业上可用电解法来处理含Cr2O72—的废水,下图为电解装置示意图(电极材料分别为铁和石墨)。通电后,Cr2O72—在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去。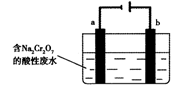
a电极的电极反应式是,
b电极附近反应的离子方程式是。
A、B、C、D是中学化学常见的四种物质,它们的转化关系如下: A + B =" C" + D
(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,则A中非氧元素的气态氢化物M的电子
式为;分子的稳定性B M(填“>”、“<”或“=”)
(2)若A、D是两种单质,B是黑色有磁性的氧化物,B与盐酸反应生成溶液N,检验N溶液中低价金属阳离子的方法是。
将D的粉末加入溶液N中,当有28gD完全溶解时,该反应转移的电子是mol。
(3)若A、B、C、D发生反应:2CO2(g) + 6H2(g) = CH3CH2OH(g) + 3H2O(g),根据下图所示信息,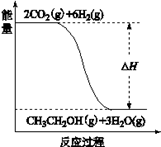
①反应是反应(填“放热”或“吸热”),判断依据是
②若△H =" a" KJ/mol,当消耗标况下5.6 L CO2时的反应热△H = KJ/mol。
③在恒温、恒容的密闭容器中,
下列描述能说明上述反应已达化学平衡状态的是(填字母序号)。
A.生成1 mol CH3CH2OH的同时,生成3 mol H2O
B.容器中各组份的物质的量浓度不随时间而变化
C.容器中混合气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化