氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C ="2AlN+3CO" 是;下列叙述正确的是
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2molAlN,N2得到3mol电子 |
| C.氮化铝中氮元素的化合价为-3 |
| D.氮化铝晶体属于分子晶体 |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:① S(单斜,s)+O2(g) ===SO2(g)△H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) ===SO2(g)△H2=-296.83 kJ·mol-1
③ S(单斜,s) ===S(正交,s)△H3
下列说法正确的是()
| A.△H3=—0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)===S(正交,s)△H3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)===S(正交,s)△H3>0,单斜硫比正交硫稳定 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |

 下列说法正确的是:
下列说法正确的是: A.反应达到平衡时,X的转化率为60%
A.反应达到平衡时,X的转化率为60% B.反应可表示为X+3Y
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600 C.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.增大压强使平衡向生成Z的方向移动,平衡常数增大 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
| A.1mol/L氢氰酸溶液的pH约为3 |
| B.HCN易溶于水 |
| C.10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应 |
| D.在相同条件下,HCN溶液的导电性比强酸溶液的弱 |
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(气)+B(气) 2C(气),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法,其中正确的是
2C(气),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法,其中正确的是
| A.用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1 |
| B.用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1 |
| C.2 s 时物质 A的转化率为70% |
| D.2 s 时物质 B的浓度为 0.7 mol·L-1 |
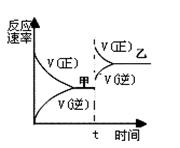
在密闭容器中,反应N2(g)+3H2(g) 2NH3(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
2NH3(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
| A.加入适当催化剂 | B.升高温度 | C.增大反应物的浓度 | D.增大压强 |