在容积不变的密闭容器中存在如下反应: 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
| A.图I表示的是t1时刻增大反应物的浓度对反应速率的影响 |
| B.图II表示的一定是^时刻加入催化剂后对反应速率的影响 |
| C.图III表示的是温度对化学平衡的影响,且乙的温度较高 |
| D.图III表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
下列关于电解质电离的叙述中,正确的是
| A.碳酸钙在水中溶解度很小,其溶液的电阻率很大,所以碳酸钙是弱电解质 |
| B.碳酸钙在水中的溶解度很小,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质 |
| C.氯气和氨气的水溶液导电性都很好,所以它们是强电解质 |
| D.水难电离,纯水几乎不导电,所以水是非电解质 |
在一定体积pH=a的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,用去Ba(OH)2溶液与NaHSO4溶液的体积比为1:4,所得溶液pH为11,则a值等于
| A.10 | B.11 | C.12 | D.13 |
对于可逆反应A(g)+2B(g) 2C(g)(正反应吸热),下列图象中正确的是
2C(g)(正反应吸热),下列图象中正确的是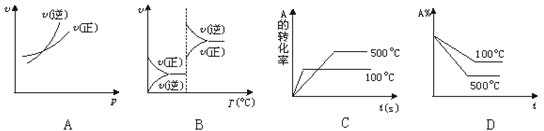
合成氨时,既要使合成氨的产率增大,又要使反应速率加快,可采取的办法是
①减压②加压③升温④降温⑤及时从平衡混合气体中分离出NH3
⑥补充N2或H2⑦加催化剂⑧减小N2或H2的量
| A.③④⑤⑦ | B.②⑤⑥ | C.②⑥ | D.②③⑥⑦ |
下列关于盐类水解反应说法正确的是
| A.任何盐都可发生水解反应 |
| B.盐只能发生水解反应而不能发生其他反应 |
| C.盐水解反应肯定能破坏水的电离平衡且促进水的电离 |
| D.盐的水溶液为中性时,则盐一定不发生水解反应 |