(14分)某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
| 物质 |
甲醇 |
苯甲酸 |
苯甲酸甲酯 |
| 沸点/℃ |
64.7 |
249 |
199.6 |
I.合成苯甲酸甲酯粗产品
在园底烧瓶中加人12.2g 苯甲酸和20 mL 甲醇(密度约0.79g · mL-1) ,再小心加人3 mL 浓硫酸,混匀后,投人几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是_________;若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:__________________。
(2)甲和乙两位同学分别设计了如下图两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用__________装置(填“甲”或“乙”)。理由是___________________。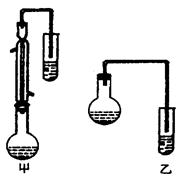
(3)反应物CH3 OH 应过量,理由是__________________________________。
II.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填人恰当操作方法的名称。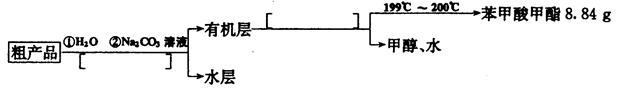
(5)以上流程图中加人Na2CO3溶液后,放人分液漏斗中振荡、静置,要得到有机层,其具体操作是______________________________________________________________________
(6)通过计算,苯甲 酸甲酯的产率为_________________________。
酸甲酯的产率为_________________________。
某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50 g 5%的氯化钠溶液。
实验一:如图是同学们做粗盐提纯实验的操作示意图。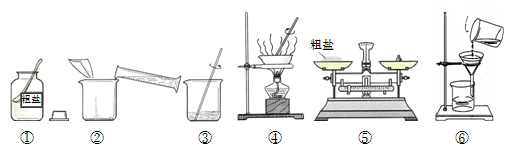
请回答下列问题:
(1)操作③中用玻璃棒搅拌的作用是 。
(2)操作⑥中的错误是 。
(3)粗盐提纯实验的操作顺序为(填操作序号) 、称量精盐并计算产率。
(4)操作④中,当观察到 时,停止加热。
实验二:用提纯得到的精盐配制了50g 5%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有 (填序号)。
①氯化钠固体仍然不纯
②量取水时,俯视读数
③称量时砝码端忘垫质量相同的纸片
④装瓶时,有少量溶液洒出
【2015海南化学】[选修2—化学与技术]
Ⅰ下列有关海水综合利用的说法正确的是 。
| A.电解饱和食盐水可制得金属钠 | B.海带提碘只涉及物理变化 |
| C.海水提溴涉及到氧化还原反应 | D.海水提镁涉及到复分解反应 |
Ⅱ
铁在自然界分别广泛,在工业、农业和国防科技中有重要应用。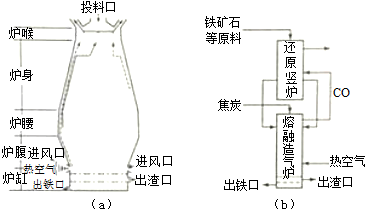
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有 。除去铁矿石中脉石(主要成分为SiO2)的化学反应方程式为 、 ;高炉排出气体的主要成分有N2、CO2和 (填化学式)。
(2)已知:①Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+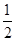 O2(g)=CO2(g)ΔH=-283kJ·mol-1
O2(g)=CO2(g)ΔH=-283kJ·mol-1
③C(s)+ 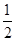 O2(g)=CO(g)ΔH=-110kJ·mol-1
O2(g)=CO(g)ΔH=-110kJ·mol-1
则反应Fe2O3 (s)+3 C(s)+ 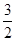 O2(g)=2Fe(s)+3CO2 (g)的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
O2(g)=2Fe(s)+3CO2 (g)的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的 部分,主要反应的化学方程式为 ;熔融造气炉相当于高炉的 部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2污染空气,脱SO2的方法是 。
【2015山东理综化学】(12分)[化学---化学与技术]工业上利用氨氧化获得的高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3,工艺流程如下: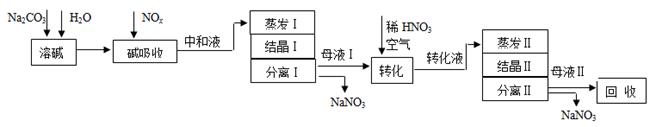
已知:Na2CO3+NO+NO2=2NaNO2+CO2
(1)中和液所含溶质除NaNO2及少量Na2CO3外,还有__________(填化学式)。
(2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是_______。蒸发Ⅰ产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的_______(填操作名称)最合理。
(3)母液Ⅰ进行转化时加入稀HNO3的目的是_______。母液Ⅱ需回收利用,下列处理方法合理的是_______。
a.转入中和液 b.转入结晶Ⅰ操作
c.转入转化液d.转入结晶Ⅱ操作
(4)若将NaNO2、NaNO3两种产品的物质的量之比设为2:1,则生产1.38吨NaNO2时,Na2CO3的理论用量为______吨(假定Na2CO3恰好完全反应)。
【2015新课标Ⅱ卷理综化学】【化学——选修2:化学与技术】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:

相关化合物的物理常数
| 物质 |
相对分子质量 |
密度(g/cm-3) |
沸点/℃ |
| 异丙苯 |
120 |
0.8640 |
153 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 苯酚 |
94 |
1.0722 |
182 |
回答下列问题:
(1)在反应器A中通入的X是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜C中加入的Y为少置浓硫酸,其作用是______,优点是用量少,缺点是_______________。
(4)反应②为 (填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是 。
(5)中和釜D中加入的Z最适宜的是 (填编号。已知苯酚是一种弱酸)。
a.NaOH b.CaCOc.NaHCO d.CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。
【2015新课标Ⅰ卷理综化学】[化学——选修2:化学与技术]氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
回答下列问题:
(1)步骤①中得到的氧化产物是_________,溶解温度应控制在60~70度,原因是__________。
(2)写出步骤③中主要反应的离子方程式___________。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是 。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有__________(填字母)
| A.分馏塔 | B.离心机 | C.反应釜 | D.框式压滤机 |
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________。