【2015海南化学】[选修2—化学与技术]
Ⅰ下列有关海水综合利用的说法正确的是 。
| A.电解饱和食盐水可制得金属钠 | B.海带提碘只涉及物理变化 |
| C.海水提溴涉及到氧化还原反应 | D.海水提镁涉及到复分解反应 |
Ⅱ
铁在自然界分别广泛,在工业、农业和国防科技中有重要应用。
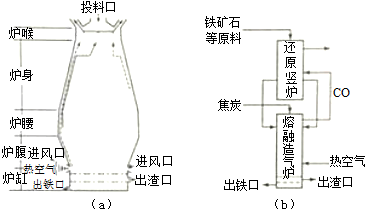
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有 。除去铁矿石中脉石(主要成分为SiO2)的化学反应方程式为 、 ;高炉排出气体的主要成分有N2、CO2和 (填化学式)。
(2)已知:①Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+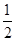 O2(g)=CO2(g) ΔH=-283kJ·mol-1
O2(g)=CO2(g) ΔH=-283kJ·mol-1
③C(s)+ 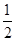 O2(g)=CO(g) ΔH=-110kJ·mol-1
O2(g)=CO(g) ΔH=-110kJ·mol-1
则反应Fe2O3 (s)+3 C(s)+ 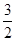 O2(g)=2Fe(s)+3CO2 (g)的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
O2(g)=2Fe(s)+3CO2 (g)的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的 部分,主要反应的化学方程式为 ;熔融造气炉相当于高炉的 部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2污染空气,脱SO2的方法是 。
某校化学课外小组的学生为了验证乙醇的分子结构,设计如下实验程序:乙醇的精制、乙醇组成元素的测定、分子式的测定、分子结构的测定。
(1)若所用乙醇中含少量水,采用直接蒸馏的方法不能有效除去水,通常向其中加入,然后蒸馏。证明乙醇不再含水,可用一种试剂检验,这种试剂是。
(2)用燃烧乙醇分析产物的方法确定含有C、H、O三种元素。
a.证明含有H元素的操作是。
b.证明含有O元素时,需取得的实验数据是:CO2的质量,H2O的质量及。
(3)为确定乙醇的分子式,在通过(2)获取乙醇的实验式之后,是否必须再测定乙醇的相对分子质量才能确定其分子式(答“是”或“否”),理由是。
(4)测定乙醇的分子结构
a.若采用红外光谱仪测定,则通过所得红外光谱中有键的振动吸收峰,即可确定乙醇的结构是CH3CH2OH而不是CH3OCH3。(填“C—H”,“C—C”,“C—O”,“O—H”)
b.若采用核磁共振仪测定,则所得乙醇的核磁共振氢谱上应有个吸收峰。
硫酸亚铁铵[ (NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用下所示方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。将处理好的铁屑放入锥形瓶,加入过量的3 mol·L-1H2SO4溶液,加热至充分反应为止。趁热过滤(如图所示),收集滤液和洗涤液。
步骤3:硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)步骤1中图13分离方法称为法。
(2)步骤2中有一处明显不合理的是。趁热过滤的理由是。
(3)步骤3加热浓缩过程中,当时停止加热。用无水乙醇洗涤晶体的原因是。
(4)FeSO4·7H2O在潮湿的空气中易被氧化成Fe(OH)SO4·3H2O,写出该反应的化学方程式。
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图9。
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图10所示。
(1)Na2S2O3·5H2O的制备:
步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。写出烧瓶内发生反应的化学方程式:。
步骤2:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH时,打开K2、关闭K1并停止加热,理由是。装置B、D的作用是。
步骤3:过滤C中的混合液,将滤液经过、、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:
向新制氯水中加入Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为①Cr2O72-+ 6I-+ 14H+2Cr3++3I2+7H2O;②I2+ 2S2O32-2I-+ S4O62-。
则该废水中Ba2+的物质的量浓度为。
如图所示3套实验装置,分别回答下列问题。
(1)装置1为铁的吸氧腐蚀实验。一段时间后,溶液略显浅绿色,表明铁被(填“氧化”或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为。
(2)装置2中的石墨是极(填“正”或“负”),该装置发生的总反应的离子方程为。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为极;甲烧杯中铁电极的电极反应为。
②乙烧杯中电解反应的离子方程式为。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中产生的气体标准状况下体积为mL。
I、为了探究HClO的漂白性,某同学设计了如下的实验。
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是。
(2)从集气瓶B中湿润的红色布条的现象可得出的结论是______________。
(3)烧杯中发生反应的化学方程式是_________________________________。
II、(1)正常雨水显酸性,其pH约值等于5.6,这是由于。
(2)某次采集的硫酸工业产区酸雨样品,每隔一段时间测定一次pH值,得数据如下
| 时间 |
开始 |
8h后 |
16h后 |
24h后 |
32h后 |
40h后 |
48h后 |
| pH |
5.0 |
4.8 |
4.6 |
4.3 |
4.2 |
4.0 |
4.0 |
酸雨样品pH值变小的主要原因是_____________________________。