实验室需要配制0.50 mol/L NaCl溶液480 mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整。
Ⅰ.(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、__________、_________________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________ g。
(3)称量。
①天平调平。 ②称量。 ③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_______________________。
(6)定容、摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶中,并贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会______(填“偏高”、“偏低”或“无影响”)。


Ⅱ.实验室利用如图装置进行中和热的测定,请回答下列问题:
(1)该图中有两处未画出,它们是________________,________________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_________________。
(3)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将________(填“偏大”、“偏小”、“不变”);原因是_______________。
请你选用下图所示仪器和药品,按实验室要求,设计一套完整的检验一氧化碳还原性和二氧化碳化学性质的实验,并回答下列问题:
实验药品:盐酸、石灰石、氧化铜粉末、木炭粉、氢氧化钙溶液。
(1)实验装置连接顺序依次为(用字母表示)___________;
(2)A装置的药品是_________,发生反应的化学方程式为_______________________;
(3)B装置中产生的实验现象是_________,发生反应的化学方程式为____________
(4)C装置中发生反应的化学方程式为____________________________________;
(5)D装置中产生的现象是_________;
(6)尾气中含有毒气体,排放到空气中会造成污染,处理方法是_________。

提供的试剂:饱和Na2CO3溶液饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有________(填仪器名称)。

请回答:
(1)各组反应开始时,装置中的气球体积先变大,该装置中反应的离子方程式是______。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 组 数 |
试剂用量 |
实验现象 (气球体积变化) |
分析原因 |
① |
0.42 g NaHCO3;0.53g Na2CO3;3mL4 mol·L-1盐酸 |
甲中气球与乙中气球的体积相等 |
甲、乙盐酸均过量,n(NaHCO3)=n(Na2CO3),ν甲(CO2)=ν乙(CO2) |
② |
0.3 g NaHCO3;0.3 g Na2CO3;3mL4 mol·L-1盐酸 |
甲中气球比乙中气球的体积大 |
|
③ |
0.6 g NaHCO3;0.6 g Na2CO3;3mL 2mol·L-1盐酸 |
甲中气球比乙中气球的体积大 |
|
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
(用离子方程式表示) |
某学生课外活动小组利用右图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是溶液;加热时溶液由红色逐渐变浅的原因是。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是溶液;加热时溶液由无色变为红色的原因是。
某校化学研究性学习小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):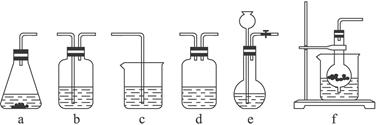
请根据题目要求完成下列问题:
(1)请按下表要求,填写选择的装置和药品。
| 分项 内容 |
CO2发生装置(随开随用,随关随停)(X) |
除杂洗气装置(Y) |
制备产品装置(Z) |
| 选择的装置(填序号) |
c |
||
| 选择的药品(填序号) |
① |
(2)如何检验所选择的CO2发生装置(X)的气密性,请写出主要操作过程:_________________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为________________________,Y装置中除去的杂质为_____________。
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是____________________。
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过_______________%(质量分数)。
附:有关物质在常温(25 ℃)时的溶解度
| 化学式 |
Na2CO3 |
NaHCO3 |
NaOH |
NaCl |
Na2SO4 |
| 溶解度(g/100 g H2O) |
21.3 |
9.60 |
107 |
35.8 |
19.4 |