有甲、乙两位同学想利用下列装置及化学试剂,对实验室制取并收集氨气的实验进行改进。
化学试剂:①NH4Cl固体 ②浓氨水 ③固体NaOH
(1)甲同学想方便快速制取少量氨气,应选择的装置是_________ (填序号)。
选用试剂是_________(填序号) ,选用上述试剂制氨气的理由是___________________。
(2)乙同学建议,把教材中实验室制取氨气的收集装置由大试管改为集气瓶且瓶口向上收集氨气,并确保不污染环境,若用这种排气法收集氨气,请在图Ⅱ的方框内画出其气体收集装置和尾气吸收装置,标出所用试剂(自选)名称。
(10分)工业合成氨气的 成功,解决了人类的重要的饥饿问题.我们在实验室中也常用NH4Cl和Ca(OH)2反应来制取一些氨气以便研究它的性质.请回答下列问题:
成功,解决了人类的重要的饥饿问题.我们在实验室中也常用NH4Cl和Ca(OH)2反应来制取一些氨气以便研究它的性质.请回答下列问题:
(1) 下图装置中能用于实验室制NH3的是____________ .
.
(2) 写出用 NH4Cl和Ca(OH)2制取氨气的反应方
NH4Cl和Ca(OH)2制取氨气的反应方 程式:_______________.
程式:_______________.
(3) 将湿润的红色石蕊试纸伸入充满氨 气的试剂瓶中可以看到的现象是___________________.
气的试剂瓶中可以看到的现象是___________________.
(4) NH3在工业上除作为制作化肥的原料外,也常用来制取硝酸,其主要步骤为:
请 写出下列反应的化学方程式:
写出下列反应的化学方程式:
NH3→ NO : _________________________________________.
Cu和浓硝酸反应:_ __________________________________________.
__________________________________________.
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 _______________________.
(2)称取铁钉6.0g放入15.0 mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除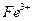 外还可能含有
外还可能含有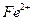 ;若要确认其中含有
;若要确认其中含有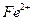 ,应首先用_________
,应首先用_________
进行检验(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.氨水 d.酸性 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
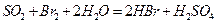 ;然后加入足量
;然后加入足量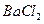 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中 的体积分数为 _____。
的体积分数为 _____。
[探究二]分析上述实验中 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有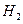 和Q气体。
和Q气体。 为此设计了下列探究实验状置(图中夹持仪器省略)。
为此设计了下列探究实验状置(图中夹持仪器省略)。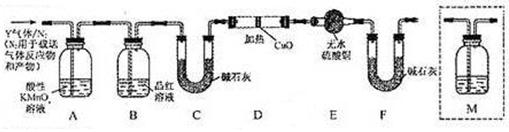
(3)装置B中试剂的作用是 __________________________;
(4)为确认Q的存在,需在装置中添加M于(选填序号)。
| A.A之前 | B.A-B间 | C.B-C间 | D.C-D间 |
(5)如果气体Y中含有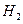 ,预计实验现象应是 ______________________
,预计实验现象应是 ______________________
____________________________
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下:
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中,试剂①最佳为(填代号),检验溶液A中Fe3+的最佳试剂为(填代号)。
a.KMnO4b.(NH4)2S c.H2O2 d.KSCN[
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为。加入CuO作用是 ____________________________________。
(2)由溶液C获得CuSO4·5H2O,需要经过一系列操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是。
(3)制备纳米材料G时,应向CaCl2溶液中先通入(或先加入)(填化学式)。
写出该反应的化学方程式 __________________________。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液
应用______________(填写仪器名称);取A溶液稀释一定倍数后,用KM nO4标
nO4标
准溶液滴定,终点现象为。
Br2和Fe3+ 的水溶液浓度较小时均呈现黄色,二者都具有较强的氧化性。某化学兴趣小组拟通过探究实验来比较二者氧化性的强弱。
实验操作:向足量的硫酸亚铁溶液中加入少量浓溴水,振荡。
实验现象:溶液由浅绿色变为黄色。
(1)提出假设:
甲同学认为氧化性:Br2 >Fe3+ ,则反应的离子方程式为;
乙同学认为氧化性:Fe3+ >Br2 ,则使溶液呈黄色的物质是(填化学式)。
(2)通过进一步实验可以检验甲和乙的结论谁对谁错,下列是设计的一些实验方案和预测:
| 方案 |
实验操作 |
预期现象及结论 |
| 1 |
取少量黄色溶液,加入NaOH溶液 |
若生成红褐色沉淀,则甲正确 |
| 2 |
取少量黄色溶液,加入淀粉KI溶液 |
若溶液变蓝色,则乙正确 |
| 3 |
取少量黄色溶液,加入苯溶液,振荡后静置 |
若上层溶液呈橙红色,则正确 |
①方案1是否合理(填“是”或“否”)。
②方案2中,由于存在反应 (用离子方程式表示),
(用离子方程式表示),
所以预测结论不正确。
③请另外设计一个合理方案,证明已经发生反应。将有关内容填入下表。
| 实验操作 |
预期现象及结论 |
用中和滴定法测定烧碱的纯度,已知烧碱中杂质不与酸反应,试根据要求填空:
(1)配置待测液:称取5.0g烧碱样品,配成250mL待测溶液;
(2)滴定:用0.2000 mol·L-1标准盐酸溶液滴定待测溶液,下面的操作错误的有 。
。
①用标准盐酸溶液润洗酸式滴定管;
②用待测烧碱溶液润洗锥形瓶;
③两个同学合作,一人控制酸式滴定管的活塞,另一人摇动锥形瓶;
④滴定过程中,操作者的眼睛始终注视酸式滴定管液面的变化。
(3)根据下表数据计算:
①待测烧碱溶液的物质的量浓度: (结果保留4位有效数字);
(结果保留4位有效数字);
②烧碱的纯度:。
| 滴定次数 |
待测溶液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读 数(mL) 数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.45 |
| 第二次 |
10.00 |
4.00 |
24.05 |