下列有关反应热的说法中正确的是
| A.一个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系 |
| B.中和热△H=" -" 57.3kJ·mol-1,所以1.00L 1.00mol·L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量 |
| C.用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大 |
| D.在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
现有三种常见治疗胃病药品的标签:( )
①②③
药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较,正确的是:
| A.①=②=③ | B.①>②>③ | C.③>②>① | D.②>③>① |
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是 ( )
A.若c(OH-)>c(H+),溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
B.溶液中不可能存在:c(Na+)>c(A-)>c(OH-)>c(H+)
C.若溶液中c(A-)=c(Na+),则溶液一定呈中性
D.若溶质为NaA、HA,则一定存在:c(A-)>c(Na+)>c(H+)>c(OH-)
用下列实验装置进行的实验,能达到相应的实验目的的是( )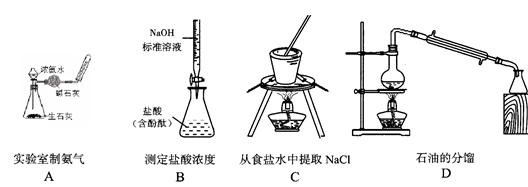
甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是()
| A.甲中沉淀一定比乙中的多 | B.甲中沉淀可能比乙中的多 |
| C.甲中沉淀一定比乙中的少 | D.实验过程中甲中和乙中的现象始终保持一致 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
| A.25℃时,PH=13的1.0L Ba(OH)2溶液中含有的OH-离子数目为0.2NA |
| B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| D.标准状况下,22.4L SO3中含有的氧原子数为3.0NA |