在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g) C2H4(g) + 4H2O(g) ΔH。CO2的平衡转化率与温度的关系如下图所示。
C2H4(g) + 4H2O(g) ΔH。CO2的平衡转化率与温度的关系如下图所示。
下列说法正确的是
| A.该反应的ΔH<0 |
| B.氢碳比:①<② |
| C.在氢碳比为2.0时,Q点v(正)<v(逆) |
| D.若起始时,CO2、H2浓度分别为0.5mol/L和1.0mol/L,则可得P点对应温度的平衡常数的值为512 |
已知化学反应2C(s)+O2(g)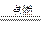 2CO(g);2CO(g) + O2(g)
2CO(g);2CO(g) + O2(g) 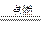 2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
| A.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量 |
| B.12gC所具有的能量一定高于28gCO所具有的能量 |
| C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量 |
| D.将两份碳燃烧,生成CO2的反应比生成CO的反应放出的热量多 |
已知热化学方程式:SO2(g)+ 1/2O2(g) 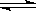 SO3(g)△H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g)△H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
| A.196.64kJ | B.196.64kJ/mol |
| C.<196.64kJ | D.>196.64kJ |
已知:2CO(g)+O2(g)="==" 2CO2(g)△=-566kJ·mol-1
N2(g)+O2(g)2NO(g)△=+180kJ·mol-1 ;则2CO(g)+2NO(g)="==" N2(g)+2CO2(g) 的△是
| A.-386 kJ·mol-1 | B.+386 kJ·mol-1 |
| C.-746 kJ·mol-1 | D.+746 kJ·mol-1 |
在密闭容器中一定量混合气体发生反应:x A (g) + y B(g)  z C(g)平衡时测得A的浓度为 0.5 mol/l,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为 0.2mol/l,下列判断正确的是
z C(g)平衡时测得A的浓度为 0.5 mol/l,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为 0.2mol/l,下列判断正确的是
| A.x+y ﹥ z | B.平衡向正反应方向移动 |
| C.B的转化率降低 | D.C的体积分数保持不变 |
.已知反应A2(g)+2B2(g)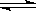 2AB2(g)△H<0,下列说法正确的是
2AB2(g)△H<0,下列说法正确的是
A升高温度有利于反应速率增加,从而缩短达到平衡的时间
B升高温度,正向反应速率增加,逆向反应速率减小
C达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D达到平衡后,降低温度 或减小压强都有利于该反应平衡正向移动
或减小压强都有利于该反应平衡正向移动